목차
1. 목적
2. 이론
3. 실험장치와 시약
4. 실험방법
5. 실험결과와 정리
6. 고찰 및 토의
7. 연구과제
2. 이론
3. 실험장치와 시약
4. 실험방법
5. 실험결과와 정리
6. 고찰 및 토의
7. 연구과제
본문내용
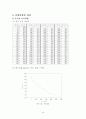
6.0
30
1500
40.0
35.5
1530
39.6
35.1
1560
39.0
35.0
1590
38.8
35.0
1620
38.2
34.9
1650
37.8
34.5
1680
37.5
34.0
1710
37.0
33.7
1740
36.5
33.4
1770
36.0
33.0
1800
35.8
32.9
1830
35.4
32.5
1860
35.0
32.4
1890
34.9
32.0
1920
34.5
31.9
1950
34.2
31.8
1980
34.0
31.7
2010
33.8
31.5
2040
33.3
31.3
2070
33.1
31.1
2100
33.0
31.0
2130
32.8
30.7
2160
32.6
30.5
2190
32.3
30.1
2220
32.1
30.0
2250
32.0
2280
31.9
2310
31.6
2340
31.4
2370
31.3
2400
31.1
2430
31.0
2460
30.9
2490
30.8
2520
30.6
2550
30.4
2580
30.2
2610
30.1
2640
30.0
(2) 각 데이터를 plot하고 T℃ 및 T'℃를 구한다.
시료1의 무게 측정
나프탈렌의 무게 --> 7g
디페닐아민의 무게 --> 3g
나프탈렌의 무게 퍼센트 --> 70%
T : 약 58℃
T': 약 45℃
시료2의 무게 측정
나프탈렌의 무게 --> 5g
디페닐아민의 무게 --> 5g
나프탈렌의 무게 퍼센트 --> 50%
T : 약 42℃
T': 약 36℃
시료3의 무게 측정
나프탈렌의 무게 --> 3g
디페닐아민의 무게 --> 7g
나프탈렌의 무게 퍼센트 --> 30%
T : 약 36℃
T': 약 31℃
6. 고찰 및 토의
이 실험에 많은 애로사항이 있었다. 우선 나프탈렌을 물중탕으로 녹인 후 꺼내어 물기를 제거하고 시간당 온도를 체크할 때 시험관을 막아놓은 고무마개 때문에 온도 확인에 어려움이 있었다. 그래서 고무마개를 최대한 얇게 해서 온도 확인으로 인한 오차를 최대한 줄이기 위해 노력했다.
그리고 실험방법에 나와있는 젖개 또한 고무마개에 철사줄이 들어가지 않아서 설치하지 못했다. 충분히 젖지 못해서 약간의 오차가 발생했을 가능성이 있다.
순수한 나프탈렌의 실재 어는점은 81℃이다. 하지만 실험에서 약간의 굴곡이 75℃ 근처에서 보여지고 있다. 이것으로 나프탈렌 10g 제조시에 불순물이 섞였을 가능성도 있다.
무엇보다 잘못된 점은 순수한 나프탈렌의 그래프는 나프탈렌이 고체화 되는 동안 같은 온도를 유지해야 하나, 그래프에서 볼 수 있듯이 온도의 거의 일정하게 계속 떨어짐을 관찰 할 수 있다. 이 큰 오류는 온도계의 위치가 잘 못되었을 것으로 추정된다. 온도계가 나프탈렌의 표면에만 살짝 걸쳐져 있어서 제대로 측정되지 않은 듯하다.
7. 연구과제
1) 여러 종류의 고체-액체 상평형 system의 phase diagram과 그 형태를 문헌에서 조사하라.
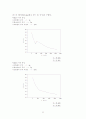
① <그림 1>에 1.00atm에서 은과 구리의 고체-액체 온도-조성 상평그림을 도시하였다.
779℃ 의 맺음선은 평형을 이룰 수 있는 두 고체상과 한 액체상을 나타내는 상태점들을 연결한 것이다. 이들 2상 고체혼합물은 일반적으로 한 상의 매우 작은 알맹이가 다른 상에 묻힌 형태를 가지므로 현미경으로 관찰하지 않는 한 마치 거의 단일상을 이룬 것처럼 보인다.
<그림 1> 은과 구리의 고체-액체 온도-조성 상평형 그림.
<그림 1>과 같은 고체-액체 상평형그림을 그리려면 조성을 알고 있는 혼합물을 녹는점 이상으로 가열한 후 이를 천천히 냉각시키면서 이때의 변화를 분석하여 구한다. <그림 2>에 구리의 몰분율을 달리하여 이같은 혼합물의 온도를 시간의 함수로 나타낸 냉각곡선을 도시하였다.
<그림 2> Ag-Cu계의 냉각 곡선.
각 곡선에서 처음 꺽이는 온도는 고체상이 처음 석출되는 온도를 나타낸다.
② <그림 3>에 1atm에서 파라-크실렌과 브로모벤젠의 고체-액체 온도 조성 상평형 그림을 도시하였다. 고체는 서로 거의 완전히 녹지 않으므로 고체 용해도 영역이 너무 작아서 그림에 나타날 수 없으며 석출되는 고체는 본질적으로 순수한 물질이다.
<그림 3> p-크실렌과 브로모 벤젠의 고체-액체 온도-조성 상평형 그림.
이상성으로 부터의 양의 편차가 너무 커서 감지할만한 고체-용해도가 없다.
2) 어는 점 내림에 의해 용매에 소량 녹인 용질의 분자량을 결정하는 방법을 조사하라.
용액의 온도를 계속해서 낮추어 주면 마침내 어느 한 온도에 이르러서 결정이 석출되기 시작하는데, 이 온도를 용액의 어는점이라고 한다. 용액에 따라서는 이때 고체용액, 즉 용질과 용매와의 균일한 고체혼합물이 석출되는 경우도 있으나 대부분의 경우에는 순수한 용매의 고체만이 석출된다. 순수한 용매만이 석출되는 경우, 용액의 어는점 순수한 용액의 어는점보다 낮으며, 이 두 온도차를 용액의 어는점내림이라고 부른다.
묽은 용액에서는 용액의 어는점내림이 용액속에 들어있는 용질의 분자수에만 비례하며 용질분자와 화학적 조성에는 관계되지 않는다. 따라서 용액속에 들어있는 용질의 분자수를 몰랄농도 m으로 표시하면 용액의 어는점내림 T는 다음과 같이 주어진다.
(1)
T = T - T
= km
여기서 T와 T는 각각 용매와 용액의 어는점이며, k는 용질의 성질에는 용매의 특성만을 나타내는 상수로서 몰랄 어는점내림상수라고 부른다. 이 상수는 1몰랄농도의 이상 용액이 나타내는 어는점내림과 같다.
주어진 양의 용매에 일정량의 용질을 녹인 다음 그 용액의 T를 측정하면 용질의 분자량을 구할 수 있다. 지금 W1g의 용매에다 분자량을 측정코자 하는 물질 W2g을 녹였다고 하자. 그러면 이 용액의 몰랄농도는 다음과 같이 된다.
여기서 M은 측정코자 하는 용질의 분자량이다. 이 식을 식 (1)에 넣어주면 다음과 같은 관계가 얻어진다.
용질이 용매 안에서 회합하거나 화학변화를 일으킬 때는 식 (3)이 그대로 적용되지 않는다.
어는점내림과 같이 용질의 성질에는 관계없이 그 농도에 의해서만 결정되는 성질을 총괄적 성질이라고 한다. 용액의 총괄적 성질에는 이 이외도 끓는점오름, 증기압내림, 삼투압이 있으며, 이들 중 어느 것을 이용하더라도 용질의 분자량을 구할 수 있다.
30
1500
40.0
35.5
1530
39.6
35.1
1560
39.0
35.0
1590
38.8
35.0
1620
38.2
34.9
1650
37.8
34.5
1680
37.5
34.0
1710
37.0
33.7
1740
36.5
33.4
1770
36.0
33.0
1800
35.8
32.9
1830
35.4
32.5
1860
35.0
32.4
1890
34.9
32.0
1920
34.5
31.9
1950
34.2
31.8
1980
34.0
31.7
2010
33.8
31.5
2040
33.3
31.3
2070
33.1
31.1
2100
33.0
31.0
2130
32.8
30.7
2160
32.6
30.5
2190
32.3
30.1
2220
32.1
30.0
2250
32.0
2280
31.9
2310
31.6
2340
31.4
2370
31.3
2400
31.1
2430
31.0
2460
30.9
2490
30.8
2520
30.6
2550
30.4
2580
30.2
2610
30.1
2640
30.0
(2) 각 데이터를 plot하고 T℃ 및 T'℃를 구한다.
시료1의 무게 측정
나프탈렌의 무게 --> 7g
디페닐아민의 무게 --> 3g
나프탈렌의 무게 퍼센트 --> 70%
T : 약 58℃
T': 약 45℃
시료2의 무게 측정
나프탈렌의 무게 --> 5g
디페닐아민의 무게 --> 5g
나프탈렌의 무게 퍼센트 --> 50%
T : 약 42℃
T': 약 36℃
시료3의 무게 측정
나프탈렌의 무게 --> 3g
디페닐아민의 무게 --> 7g
나프탈렌의 무게 퍼센트 --> 30%
T : 약 36℃
T': 약 31℃
6. 고찰 및 토의
이 실험에 많은 애로사항이 있었다. 우선 나프탈렌을 물중탕으로 녹인 후 꺼내어 물기를 제거하고 시간당 온도를 체크할 때 시험관을 막아놓은 고무마개 때문에 온도 확인에 어려움이 있었다. 그래서 고무마개를 최대한 얇게 해서 온도 확인으로 인한 오차를 최대한 줄이기 위해 노력했다.
그리고 실험방법에 나와있는 젖개 또한 고무마개에 철사줄이 들어가지 않아서 설치하지 못했다. 충분히 젖지 못해서 약간의 오차가 발생했을 가능성이 있다.
순수한 나프탈렌의 실재 어는점은 81℃이다. 하지만 실험에서 약간의 굴곡이 75℃ 근처에서 보여지고 있다. 이것으로 나프탈렌 10g 제조시에 불순물이 섞였을 가능성도 있다.
무엇보다 잘못된 점은 순수한 나프탈렌의 그래프는 나프탈렌이 고체화 되는 동안 같은 온도를 유지해야 하나, 그래프에서 볼 수 있듯이 온도의 거의 일정하게 계속 떨어짐을 관찰 할 수 있다. 이 큰 오류는 온도계의 위치가 잘 못되었을 것으로 추정된다. 온도계가 나프탈렌의 표면에만 살짝 걸쳐져 있어서 제대로 측정되지 않은 듯하다.
7. 연구과제
1) 여러 종류의 고체-액체 상평형 system의 phase diagram과 그 형태를 문헌에서 조사하라.
① <그림 1>에 1.00atm에서 은과 구리의 고체-액체 온도-조성 상평그림을 도시하였다.
779℃ 의 맺음선은 평형을 이룰 수 있는 두 고체상과 한 액체상을 나타내는 상태점들을 연결한 것이다. 이들 2상 고체혼합물은 일반적으로 한 상의 매우 작은 알맹이가 다른 상에 묻힌 형태를 가지므로 현미경으로 관찰하지 않는 한 마치 거의 단일상을 이룬 것처럼 보인다.
<그림 1> 은과 구리의 고체-액체 온도-조성 상평형 그림.
<그림 1>과 같은 고체-액체 상평형그림을 그리려면 조성을 알고 있는 혼합물을 녹는점 이상으로 가열한 후 이를 천천히 냉각시키면서 이때의 변화를 분석하여 구한다. <그림 2>에 구리의 몰분율을 달리하여 이같은 혼합물의 온도를 시간의 함수로 나타낸 냉각곡선을 도시하였다.
<그림 2> Ag-Cu계의 냉각 곡선.
각 곡선에서 처음 꺽이는 온도는 고체상이 처음 석출되는 온도를 나타낸다.
② <그림 3>에 1atm에서 파라-크실렌과 브로모벤젠의 고체-액체 온도 조성 상평형 그림을 도시하였다. 고체는 서로 거의 완전히 녹지 않으므로 고체 용해도 영역이 너무 작아서 그림에 나타날 수 없으며 석출되는 고체는 본질적으로 순수한 물질이다.
<그림 3> p-크실렌과 브로모 벤젠의 고체-액체 온도-조성 상평형 그림.
이상성으로 부터의 양의 편차가 너무 커서 감지할만한 고체-용해도가 없다.
2) 어는 점 내림에 의해 용매에 소량 녹인 용질의 분자량을 결정하는 방법을 조사하라.
용액의 온도를 계속해서 낮추어 주면 마침내 어느 한 온도에 이르러서 결정이 석출되기 시작하는데, 이 온도를 용액의 어는점이라고 한다. 용액에 따라서는 이때 고체용액, 즉 용질과 용매와의 균일한 고체혼합물이 석출되는 경우도 있으나 대부분의 경우에는 순수한 용매의 고체만이 석출된다. 순수한 용매만이 석출되는 경우, 용액의 어는점 순수한 용액의 어는점보다 낮으며, 이 두 온도차를 용액의 어는점내림이라고 부른다.
묽은 용액에서는 용액의 어는점내림이 용액속에 들어있는 용질의 분자수에만 비례하며 용질분자와 화학적 조성에는 관계되지 않는다. 따라서 용액속에 들어있는 용질의 분자수를 몰랄농도 m으로 표시하면 용액의 어는점내림 T는 다음과 같이 주어진다.
(1)
T = T - T
= km
여기서 T와 T는 각각 용매와 용액의 어는점이며, k는 용질의 성질에는 용매의 특성만을 나타내는 상수로서 몰랄 어는점내림상수라고 부른다. 이 상수는 1몰랄농도의 이상 용액이 나타내는 어는점내림과 같다.
주어진 양의 용매에 일정량의 용질을 녹인 다음 그 용액의 T를 측정하면 용질의 분자량을 구할 수 있다. 지금 W1g의 용매에다 분자량을 측정코자 하는 물질 W2g을 녹였다고 하자. 그러면 이 용액의 몰랄농도는 다음과 같이 된다.
여기서 M은 측정코자 하는 용질의 분자량이다. 이 식을 식 (1)에 넣어주면 다음과 같은 관계가 얻어진다.
용질이 용매 안에서 회합하거나 화학변화를 일으킬 때는 식 (3)이 그대로 적용되지 않는다.
어는점내림과 같이 용질의 성질에는 관계없이 그 농도에 의해서만 결정되는 성질을 총괄적 성질이라고 한다. 용액의 총괄적 성질에는 이 이외도 끓는점오름, 증기압내림, 삼투압이 있으며, 이들 중 어느 것을 이용하더라도 용질의 분자량을 구할 수 있다.