목차
1. 실험이론
1) 흡광광도 분석법
2) Lambert-Beer's law
3) 흡광도를 이용한 Lambert-Beer's law
4) 흡광광도법의 원리 및 적용
5) 측 정
2. 실험방법
3. 실험장치
4. 결과 및 고찰
1) 실험계산 및 결과
2) 결과고찰
3) 문제풀이
5. 참고문헌
1) 흡광광도 분석법
2) Lambert-Beer's law
3) 흡광도를 이용한 Lambert-Beer's law
4) 흡광광도법의 원리 및 적용
5) 측 정
2. 실험방법
3. 실험장치
4. 결과 및 고찰
1) 실험계산 및 결과
2) 결과고찰
3) 문제풀이
5. 참고문헌
본문내용
이프스, 메스플라스크(100㎖) 2개, 유산지
Fig 3. 분광광도계(Spectronic 20D)의 구조 및 각 부분의 명칭
<시 약>
시약명
화학식
분자량
특징 및 주의사항
과망간산칼륨
KMnO4
158.04
비중은 2.703, 공기 중에서는 안정하고 물에 잘 녹음. 산화제로 쓰임. 감광분해.
증류수
H2O
18.02
물을 가열했을 때 발생하는 수증기를 냉각시켜 탈염(脫鹽) 정제된 물. 완전히 순수한 물은 pH 5.7(평형수)인데공기 중에 방치하면 이산화탄소를 흡수하여 pH 5.7 정도(약한 산성)가 됨.
4. 결과 및 고찰
1) 실험계산 및 결과
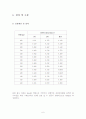
파장(nm)
흡광도(absorbance)
1회
2회
평균
600
0.08
0.178
0.129
580
0.183
0.315
0.249
560
0.398
0.482
0.440
540
0.628
0.516
0.572
530
0.642
0.518
0.580
525
0.638
0.518
0.578
520
0.632
0.516
0.574
510
0.560
0.512
0.536
500
0.498
0.500
0.499
480
0.945
0.416
0.6805
460
0.426
0.259
0.3425
440
0.185
0.119
0.152
420
0.080
0.058
0.069
400
0.101
0.079
0.090
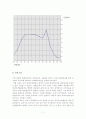
최대 흡수 파장은 Data를 바탕으로 이루어진 실험적인 과망간산칼륨 용액의 흡 수곡선을 다룬 그래프(다음 장)를 보면 알 수 있듯이 실험적으로는 480nm로 측 정되었다.
(흡광도)
파장(㎚)
2) 결과고찰
이번 실험은 분광광도계의 작동원리와 사용법을 알아서 시료의 흡광광도를 반복 측정하여 데이터를 해석하여 최대흡수파장을 결정하기까지였다.
실험 과정은 크게 과망간산칼륨 수용액의 조제와 분광광도계로 흡광광도를 측정하는 둘로 구분할 수 있었다. 실험할 때의 주의 사항은 시약은 정확히 제조해야 하며 과망간산칼륨용액은 햇빛에 반응하면 분해 되므로 항상 갈색병이나 은박지들을 감싸주어 과망간산칼륨용액이 햇빛에 노출되는 것을 방지해야 하였다. 시료용액의 투과율을 흡광도로 환산하는 과정까지 수회를 반복하는 과정이 번거로웠다. 또한 분광광도계가 워낙 미세한 충격에도 수치가 흔들리기 때문에 0점과 투과도100조정에 있어서도 어려움이 있었다.
시험액의 제조는 비교적 정확했으나 1회 실험을 할 동안 과망간산칼륨용액 제조 후 갈색병이나 은박지로 감싸주는 것을 잊어 버려 직사광선에 장시간 노출시켜 과망간산칼륨용액의 분해가 일어나 농도가 달라 흡광도 차가 난 것 같다. 다음 실험시 흡광광도가 흔들리는 것과 시험액 조제 후 바로 은박지로 감싸주는 것만 크게 주의한다면 실험에서의 오차는 크게 줄일 수 있을 것 같다.
3) 문제풀이
(1) 분광광도계의 사용법을 열거하라. 단, spectronic 20D 각 부분의 명칭을 이용하여 설명하라.
1) 0점조절손잡이를 시계방향으로 돌려 분광광도계를 구동시킨다.
2) 램프의 광원을 일정하게 하기 위하여 2~3분간 워밍업(warming-up) 시킨다.
3) 0점조절손잡이를 돌려 LED계기판이 0을 나타내도록 조정한다(0점조정).
4) 증류수가 담긴 셀을 셀어뎁터에 꽂는다. 이 때 셀의 화살표 방향이 전방을 향하도록 한다.
5) 광량조절손잡이를 돌려 투과도를 100으로 조정한다(100%조정).
6) 0점조정 및 100%조정을 3회 반복한다.
7) 증류수 셀을 제거하고 KMnO4 용액을 셀에 넣어 꽂는다.
8) 600~420nm까지 적절한 파장 간격으로 흡광도를 측정한다.
(파장 조절시 마다 1~7번까지 2회반복한다)
(2) K2CrO4의 염기성 용액은 366nm에서 최대흡수파장을 나타낸다. K2CrO4를 포함한 염기성 용액을 1.0cm의 셀을 사용하여 흡광도를 측정하고자 한다. 측정 가능한 농도의 범위는 얼마인가?
단, %T는 1%까지 측정할 수 있다고 가정하고 K2CrO4의 흡광계수 K는 366nm에서 4400이라고 가정하라.
%T의 최소치가 1%라면 1%≤%T≤100%일 것이다.
그러면 A는 1≤A≤2이다.
최대 파장일 때 K값은 4400이고 L값은 10mm이다
ε : 비례상수로서 흡광계수라하고, C=1mol, L=10㎜일 때의 ε의 값을 몰흡광계수라 하며 K로 표시한다
= 4.5× 10-4 mol
= 2.3× 10-4 mol
그러므로 농도 범위 C는 2.3× 10-4 mol ≤ C ≤ 4.5× 10-4 mol 이다.
5. 참고문헌
응용화공기초실험1
인터넷 야후 및 네이버 ‘기기분석법- 흡광광도법’ 검색
Fig 3. 분광광도계(Spectronic 20D)의 구조 및 각 부분의 명칭
<시 약>
시약명
화학식
분자량
특징 및 주의사항
과망간산칼륨
KMnO4
158.04
비중은 2.703, 공기 중에서는 안정하고 물에 잘 녹음. 산화제로 쓰임. 감광분해.
증류수
H2O
18.02
물을 가열했을 때 발생하는 수증기를 냉각시켜 탈염(脫鹽) 정제된 물. 완전히 순수한 물은 pH 5.7(평형수)인데공기 중에 방치하면 이산화탄소를 흡수하여 pH 5.7 정도(약한 산성)가 됨.
4. 결과 및 고찰
1) 실험계산 및 결과
파장(nm)
흡광도(absorbance)
1회
2회
평균
600
0.08
0.178
0.129
580
0.183
0.315
0.249
560
0.398
0.482
0.440
540
0.628
0.516
0.572
530
0.642
0.518
0.580
525
0.638
0.518
0.578
520
0.632
0.516
0.574
510
0.560
0.512
0.536
500
0.498
0.500
0.499
480
0.945
0.416
0.6805
460
0.426
0.259
0.3425
440
0.185
0.119
0.152
420
0.080
0.058
0.069
400
0.101
0.079
0.090
최대 흡수 파장은 Data를 바탕으로 이루어진 실험적인 과망간산칼륨 용액의 흡 수곡선을 다룬 그래프(다음 장)를 보면 알 수 있듯이 실험적으로는 480nm로 측 정되었다.
(흡광도)
파장(㎚)
2) 결과고찰
이번 실험은 분광광도계의 작동원리와 사용법을 알아서 시료의 흡광광도를 반복 측정하여 데이터를 해석하여 최대흡수파장을 결정하기까지였다.
실험 과정은 크게 과망간산칼륨 수용액의 조제와 분광광도계로 흡광광도를 측정하는 둘로 구분할 수 있었다. 실험할 때의 주의 사항은 시약은 정확히 제조해야 하며 과망간산칼륨용액은 햇빛에 반응하면 분해 되므로 항상 갈색병이나 은박지들을 감싸주어 과망간산칼륨용액이 햇빛에 노출되는 것을 방지해야 하였다. 시료용액의 투과율을 흡광도로 환산하는 과정까지 수회를 반복하는 과정이 번거로웠다. 또한 분광광도계가 워낙 미세한 충격에도 수치가 흔들리기 때문에 0점과 투과도100조정에 있어서도 어려움이 있었다.
시험액의 제조는 비교적 정확했으나 1회 실험을 할 동안 과망간산칼륨용액 제조 후 갈색병이나 은박지로 감싸주는 것을 잊어 버려 직사광선에 장시간 노출시켜 과망간산칼륨용액의 분해가 일어나 농도가 달라 흡광도 차가 난 것 같다. 다음 실험시 흡광광도가 흔들리는 것과 시험액 조제 후 바로 은박지로 감싸주는 것만 크게 주의한다면 실험에서의 오차는 크게 줄일 수 있을 것 같다.
3) 문제풀이
(1) 분광광도계의 사용법을 열거하라. 단, spectronic 20D 각 부분의 명칭을 이용하여 설명하라.
1) 0점조절손잡이를 시계방향으로 돌려 분광광도계를 구동시킨다.
2) 램프의 광원을 일정하게 하기 위하여 2~3분간 워밍업(warming-up) 시킨다.
3) 0점조절손잡이를 돌려 LED계기판이 0을 나타내도록 조정한다(0점조정).
4) 증류수가 담긴 셀을 셀어뎁터에 꽂는다. 이 때 셀의 화살표 방향이 전방을 향하도록 한다.
5) 광량조절손잡이를 돌려 투과도를 100으로 조정한다(100%조정).
6) 0점조정 및 100%조정을 3회 반복한다.
7) 증류수 셀을 제거하고 KMnO4 용액을 셀에 넣어 꽂는다.
8) 600~420nm까지 적절한 파장 간격으로 흡광도를 측정한다.
(파장 조절시 마다 1~7번까지 2회반복한다)
(2) K2CrO4의 염기성 용액은 366nm에서 최대흡수파장을 나타낸다. K2CrO4를 포함한 염기성 용액을 1.0cm의 셀을 사용하여 흡광도를 측정하고자 한다. 측정 가능한 농도의 범위는 얼마인가?
단, %T는 1%까지 측정할 수 있다고 가정하고 K2CrO4의 흡광계수 K는 366nm에서 4400이라고 가정하라.
%T의 최소치가 1%라면 1%≤%T≤100%일 것이다.
그러면 A는 1≤A≤2이다.
최대 파장일 때 K값은 4400이고 L값은 10mm이다
ε : 비례상수로서 흡광계수라하고, C=1mol, L=10㎜일 때의 ε의 값을 몰흡광계수라 하며 K로 표시한다
= 4.5× 10-4 mol
= 2.3× 10-4 mol
그러므로 농도 범위 C는 2.3× 10-4 mol ≤ C ≤ 4.5× 10-4 mol 이다.
5. 참고문헌
응용화공기초실험1
인터넷 야후 및 네이버 ‘기기분석법- 흡광광도법’ 검색
추천자료
 Ch5. Exclusive OR 게이트와 응용<디지털회로실험//경희대학교>
Ch5. Exclusive OR 게이트와 응용<디지털회로실험//경희대학교> (화공 실험)FT-IR 레포트
(화공 실험)FT-IR 레포트 (화공 실험)열분석 레포트
(화공 실험)열분석 레포트 [화공]분쇄실험 보고서
[화공]분쇄실험 보고서 [화공실험]PFR 파이널
[화공실험]PFR 파이널 [화공실험]열풍온도제어 파이널
[화공실험]열풍온도제어 파이널 [화공실험]혼합조 실험 파이널
[화공실험]혼합조 실험 파이널 GC HPLC 기기분석 실험레포트
GC HPLC 기기분석 실험레포트 화공실험 건조
화공실험 건조 기기 분석 및 실험 ICP
기기 분석 및 실험 ICP  화학공학 기초 실험 - (결과) 염색 실험
화학공학 기초 실험 - (결과) 염색 실험 [응용화학실험] 공업용수 경도측정 : 공업 용수로 사용되는데 적합한 수질을 평가할 때 가장 ...
[응용화학실험] 공업용수 경도측정 : 공업 용수로 사용되는데 적합한 수질을 평가할 때 가장 ... [전자회로 기초 실험] 중첩의 원리 : 중첩의 원리를 실험적으로 확인한다.
[전자회로 기초 실험] 중첩의 원리 : 중첩의 원리를 실험적으로 확인한다. [화공실험] 증류탑 자동제어 결과 : 증류탑의 자동 제어장치 조작하며 떻게 제어가 되는지 알...
[화공실험] 증류탑 자동제어 결과 : 증류탑의 자동 제어장치 조작하며 떻게 제어가 되는지 알...





























소개글