목차
1. 원리 및 목적
● 핵심개념
● 나일론
● 나일론의 성질
● 실험이론
● 원 리
2. 실험방법
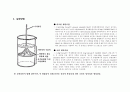
● 비교반 계면중합
● 교반 계면중합
● 나일론 생성 반응에서 NaOH의 역할
● 주의 및 참고사항
3. 실험 기구와 재료
● 시 약
● 기 구
4. 나일론 6,10의 합성 실험보고서
● 나일론 6, 10의 수율을 조사하라.
● 나일론 6, 10의 녹는점을 측정하라.
● 중합에 NaOH를 사용하는 목적은 무엇인가?
● 나일론 6, 10의 세척에 혼합용매를 사용하는 이유는 무엇인가?
● 나일론 6, 6와 나일론 6, 10의 물성(녹는점, 기계적 강도 등)을 구조로부터 예측 비교해보라.
● 공업적으로 이용되는 나일론의 중합방법은 괴상중합니다. 계면중합이 공업적으로 이용되지 않는 이유는 무엇인가?
● 핵심개념
● 나일론
● 나일론의 성질
● 실험이론
● 원 리
2. 실험방법
● 비교반 계면중합
● 교반 계면중합
● 나일론 생성 반응에서 NaOH의 역할
● 주의 및 참고사항
3. 실험 기구와 재료
● 시 약
● 기 구
4. 나일론 6,10의 합성 실험보고서
● 나일론 6, 10의 수율을 조사하라.
● 나일론 6, 10의 녹는점을 측정하라.
● 중합에 NaOH를 사용하는 목적은 무엇인가?
● 나일론 6, 10의 세척에 혼합용매를 사용하는 이유는 무엇인가?
● 나일론 6, 6와 나일론 6, 10의 물성(녹는점, 기계적 강도 등)을 구조로부터 예측 비교해보라.
● 공업적으로 이용되는 나일론의 중합방법은 괴상중합니다. 계면중합이 공업적으로 이용되지 않는 이유는 무엇인가?
본문내용
Sebacic acid
=> 1,10-decanedioic acid(HOOC(CH2)8COOH)의 화학식을 갖는다. 외관은 횐색의가루이고, 녹는점은 133℃ ∼ 136℃, 비점은 295℃ /100mmHg이다. 메탄올, 에탄올, 에테르에는 녹으나, 물에는 잘 녹지 않는다.
○ Thionyl Chloride
=> 외관은 무색내지 엷은 담황색이나 불그스레한 갈색, 증발시킴, 자극성을 지닌 액체, 숨막히게 하는 향기가 난다. 분자량은 118.97이고 분자식은 Cl2-S-O이다. 끓는점은 167F ∼ 174F(75℃ ∼ 79℃)이고, 녹는점은 -193 ∼ -155F(-125℃ ∼ -104℃)이다. 증기압은 97mmHg(20℃에서)이고 증기밀도는 4.1이고, 비중은 1.631 ∼ 1.638이다. 물에 녹는다.
○ 사염화에틸렌 혹은 (CCl4)
=> 에테르와 비슷한 냄새가 나고 무색투명한 액체이다. 사염화에틸렌·퍼클로라이드에틸렌이라고도 한다. 녹는점은 -19℃이고, 끓는점은 121℃, 비중은 1.620이다.
○ 헥사메틸렌디아민
=> 소판 또는 소엽상의 결정 1,6-디아미노헥산이라고도 한다. 화학식 H2N(CH2)6NH2. 분자량 116, 끓는점 100℃(20 mmHg), 녹는점 42℃. 물·에탄올·벤젠 등에 녹는다.
○ NaOH
=> 수산화나트륨(Sodium Hydroxide)이라고 한다. 분자량 39.99707, 녹는점 318℃, 끓는점 1,390℃, 밀도 2.13이다. 물에 대한 용해도는 50g/100ml이고, 부식성이 있고, 무색, 무취의 고체이다.
○ 페놀프탈레인 지시약
=> 산과 알칼리를 구별하는 지시약(指示藥)으로서 알려져 있다. 화학식 C20H14O4. 무색∼약간 황색을 띤 백색 결정이며, 분자량 318.33, 녹는점 262∼264℃이다. 고온에서는 승화한다. 에탄올에는 녹지만 에테르에는 잘 녹지 않으며, 물에는 거의 녹지 않는다. 산성 용액 속에서는 무색이며, pH 9 정도에서는 홍적색(紅赤色)이 되고, 그보다 pH가 높은 알칼리성 용액에서는 그 색을 유지한다
○ 아세톤
=> 디메틸케톤·프로판온이라고도 한다. 화학식 CH3COCH3. 무색의 휘발성 액체로 분자량 58.08이다. 물·알코올이나 에테르에는 잘 녹는다. 에테르와 비슷한 냄새를 가지며 마취작용이 있다. 환원성이 없으므로 펠링용액과 반응하지 않는다. 목초(木醋) 속에 함유되어 있는데, 생체내에도 아세톤체로서 혈액이나 소변 속에 미량 함유되어 있다.
○ 메탄올
=> 메틸알코올이라고도 한다. 분자식 CH3OH. 분자량 32.04, 어는점 -97.78℃, 끓는점 64.65℃, 비중 0.7928이다. 메탄의 수소원자 1개를 히드록시기 -OH로 치환한 것으로 간주하여 메탄올이라 한다.
● 기 구
○ 100㎖, 300㎖ 둥근바닥플라스크
○ 감압증류장치
○ 수조 또는 hot plate
○ 500㎖ 분리 반응조(교반기 부착)
○ 진공 오븐 ○ 분별깔때기
○ 핀셋 ○ 50㎖, 100㎖ 비커
○ 유리막대 ○ 10㎖, 100㎖ 눈금실린더
○ 냉각기
○ 흡입병 + glass filter 또는 Buchner 깔때기
4. 나일론 6,10의 합성 실험보고서
● 나일론 6, 10의 수율을 조사하라.
=>
● 나일론 6, 10의 녹는점을 측정하라.
○ 나일론의 녹는점
- 6,6-나일론 : [-NH(CH2)6NHCO(CH2)4CO-]n (녹는점 264℃)
- 6,10-나일론 : [-NH(CH2)6NHCO(CH2)8CO-]n (녹는점 209℃)
- 6-나일론 : [-NH(CH2)5CO-]n (녹는점 215℃)
- 7-나일론 : [-NH(CH2)6CO-]n (녹는점 225℃)
- 11-나일론 : [-NH(CH2)10CO-]n (녹는점 118℃)
● 중합에 NaOH를 사용하는 목적은 무엇인가?
=> 나일론은 바로 탄소화합물이다. 분자말단에는 COOH기가 붙어있다. 수산화 나트륨은 (OH)를 포함한 염기이다. (COOH)와 OH만나면 물이빠지면서 결합을 한다. 이런것들이 무한하게 많은 것들이 붙는다. 이렇게 COOH와 OH가 만나서 부산물이 빠지는 반응을 축합반응이라고 한다. 그러면 이 분자는 엄청난 분자량을 가진 고분자가 되는 것이다.
● 나일론 6, 10의 세척에 혼합용매를 사용하는 이유는 무엇인가?
=> 나일론 6, 10의 세척에 물-메탄올(1:1), 물-아세톤(1:1) 이렇게 혼합용액을 사용하는 이유는 Sebacic acid는 물에는 잘 녹지 않으나 메탄올, 에탄올, 에테르에는 잘 녹기 때문에 제거가 가능하다. 그리고 Thionyl Chloride은 물에 잘 녹기 때문에 이 또한 제거가 가능하다. 따라서 이 두가지를 모두 제거하기 위해 혼합용매를 쓰는 것이다.
● 나일론 6, 6와 나일론 6, 10의 물성(녹는점, 기계적 강도 등)을 구조로부터 예측 비교해보라.
=>
● 공업적으로 이용되는 나일론의 중합방법은 괴상중합니다. 계면중합이 공업적으로 이용되지 않는 이유는 무엇인가?
=> 계면중합법의 특징은, 반응조건이 온화하여 폴리머중에 이종구조가 발생하기 어렵고, 중합후의 세정공정에서 부생성물인 염화나트륨등의 염류, 중합촉매(예:지방족 제3급 아민) 및 미반응 비스페놀 A가 거의 완벽하게 제거가능하여 고순도의 폴리머를 얻을 수 있다는 이점이 있다. 반면, 결점으로는, 세정·용매회수공정의 부하가 크다는 점, 폴리카보네이트의 염화메틸렌용액에서 폴리카보네이트의 입자화·회수공정의 제어가 어렵고, 입자화 후의 건조공정이 필요하다는 점이다.
※ 괴상중합 : 용제가 없는 상태에서 단위체만을 중합시키는 방법이다. 벌크중합이라고도 한다. 고대부터 알려져 있는 가장 간단한 중합방법으로, 장치가 비교적 간단하고 반응이 빠르며, 수득률이 높고 고순도의 중합체를 얻을 수 있으며, 중합체를 그대로 취급할 수 있는 것이 장점이다. 그러나 중합계의 발열이 강하여 온도조절이 어렵고, 중합체의 분자량분포가 넓어지며, 중합체의 석출이 쉽지 않은 단점도 있다. 액체상 또는 기체상의 단위체중합에 잘 이용된다. 축합중합에 이용할 때는 강하게 발열하는 일은 적다. 중합반응의 기초적인 연구를 위해 실험실에서 시행되며, 공업적으로도 유기유리로서의 아크릴수지 제조 등에 이용된다.
=> 1,10-decanedioic acid(HOOC(CH2)8COOH)의 화학식을 갖는다. 외관은 횐색의가루이고, 녹는점은 133℃ ∼ 136℃, 비점은 295℃ /100mmHg이다. 메탄올, 에탄올, 에테르에는 녹으나, 물에는 잘 녹지 않는다.
○ Thionyl Chloride
=> 외관은 무색내지 엷은 담황색이나 불그스레한 갈색, 증발시킴, 자극성을 지닌 액체, 숨막히게 하는 향기가 난다. 분자량은 118.97이고 분자식은 Cl2-S-O이다. 끓는점은 167F ∼ 174F(75℃ ∼ 79℃)이고, 녹는점은 -193 ∼ -155F(-125℃ ∼ -104℃)이다. 증기압은 97mmHg(20℃에서)이고 증기밀도는 4.1이고, 비중은 1.631 ∼ 1.638이다. 물에 녹는다.
○ 사염화에틸렌 혹은 (CCl4)
=> 에테르와 비슷한 냄새가 나고 무색투명한 액체이다. 사염화에틸렌·퍼클로라이드에틸렌이라고도 한다. 녹는점은 -19℃이고, 끓는점은 121℃, 비중은 1.620이다.
○ 헥사메틸렌디아민
=> 소판 또는 소엽상의 결정 1,6-디아미노헥산이라고도 한다. 화학식 H2N(CH2)6NH2. 분자량 116, 끓는점 100℃(20 mmHg), 녹는점 42℃. 물·에탄올·벤젠 등에 녹는다.
○ NaOH
=> 수산화나트륨(Sodium Hydroxide)이라고 한다. 분자량 39.99707, 녹는점 318℃, 끓는점 1,390℃, 밀도 2.13이다. 물에 대한 용해도는 50g/100ml이고, 부식성이 있고, 무색, 무취의 고체이다.
○ 페놀프탈레인 지시약
=> 산과 알칼리를 구별하는 지시약(指示藥)으로서 알려져 있다. 화학식 C20H14O4. 무색∼약간 황색을 띤 백색 결정이며, 분자량 318.33, 녹는점 262∼264℃이다. 고온에서는 승화한다. 에탄올에는 녹지만 에테르에는 잘 녹지 않으며, 물에는 거의 녹지 않는다. 산성 용액 속에서는 무색이며, pH 9 정도에서는 홍적색(紅赤色)이 되고, 그보다 pH가 높은 알칼리성 용액에서는 그 색을 유지한다
○ 아세톤
=> 디메틸케톤·프로판온이라고도 한다. 화학식 CH3COCH3. 무색의 휘발성 액체로 분자량 58.08이다. 물·알코올이나 에테르에는 잘 녹는다. 에테르와 비슷한 냄새를 가지며 마취작용이 있다. 환원성이 없으므로 펠링용액과 반응하지 않는다. 목초(木醋) 속에 함유되어 있는데, 생체내에도 아세톤체로서 혈액이나 소변 속에 미량 함유되어 있다.
○ 메탄올
=> 메틸알코올이라고도 한다. 분자식 CH3OH. 분자량 32.04, 어는점 -97.78℃, 끓는점 64.65℃, 비중 0.7928이다. 메탄의 수소원자 1개를 히드록시기 -OH로 치환한 것으로 간주하여 메탄올이라 한다.
● 기 구
○ 100㎖, 300㎖ 둥근바닥플라스크
○ 감압증류장치
○ 수조 또는 hot plate
○ 500㎖ 분리 반응조(교반기 부착)
○ 진공 오븐 ○ 분별깔때기
○ 핀셋 ○ 50㎖, 100㎖ 비커
○ 유리막대 ○ 10㎖, 100㎖ 눈금실린더
○ 냉각기
○ 흡입병 + glass filter 또는 Buchner 깔때기
4. 나일론 6,10의 합성 실험보고서
● 나일론 6, 10의 수율을 조사하라.
=>
● 나일론 6, 10의 녹는점을 측정하라.
○ 나일론의 녹는점
- 6,6-나일론 : [-NH(CH2)6NHCO(CH2)4CO-]n (녹는점 264℃)
- 6,10-나일론 : [-NH(CH2)6NHCO(CH2)8CO-]n (녹는점 209℃)
- 6-나일론 : [-NH(CH2)5CO-]n (녹는점 215℃)
- 7-나일론 : [-NH(CH2)6CO-]n (녹는점 225℃)
- 11-나일론 : [-NH(CH2)10CO-]n (녹는점 118℃)
● 중합에 NaOH를 사용하는 목적은 무엇인가?
=> 나일론은 바로 탄소화합물이다. 분자말단에는 COOH기가 붙어있다. 수산화 나트륨은 (OH)를 포함한 염기이다. (COOH)와 OH만나면 물이빠지면서 결합을 한다. 이런것들이 무한하게 많은 것들이 붙는다. 이렇게 COOH와 OH가 만나서 부산물이 빠지는 반응을 축합반응이라고 한다. 그러면 이 분자는 엄청난 분자량을 가진 고분자가 되는 것이다.
● 나일론 6, 10의 세척에 혼합용매를 사용하는 이유는 무엇인가?
=> 나일론 6, 10의 세척에 물-메탄올(1:1), 물-아세톤(1:1) 이렇게 혼합용액을 사용하는 이유는 Sebacic acid는 물에는 잘 녹지 않으나 메탄올, 에탄올, 에테르에는 잘 녹기 때문에 제거가 가능하다. 그리고 Thionyl Chloride은 물에 잘 녹기 때문에 이 또한 제거가 가능하다. 따라서 이 두가지를 모두 제거하기 위해 혼합용매를 쓰는 것이다.
● 나일론 6, 6와 나일론 6, 10의 물성(녹는점, 기계적 강도 등)을 구조로부터 예측 비교해보라.
=>
● 공업적으로 이용되는 나일론의 중합방법은 괴상중합니다. 계면중합이 공업적으로 이용되지 않는 이유는 무엇인가?
=> 계면중합법의 특징은, 반응조건이 온화하여 폴리머중에 이종구조가 발생하기 어렵고, 중합후의 세정공정에서 부생성물인 염화나트륨등의 염류, 중합촉매(예:지방족 제3급 아민) 및 미반응 비스페놀 A가 거의 완벽하게 제거가능하여 고순도의 폴리머를 얻을 수 있다는 이점이 있다. 반면, 결점으로는, 세정·용매회수공정의 부하가 크다는 점, 폴리카보네이트의 염화메틸렌용액에서 폴리카보네이트의 입자화·회수공정의 제어가 어렵고, 입자화 후의 건조공정이 필요하다는 점이다.
※ 괴상중합 : 용제가 없는 상태에서 단위체만을 중합시키는 방법이다. 벌크중합이라고도 한다. 고대부터 알려져 있는 가장 간단한 중합방법으로, 장치가 비교적 간단하고 반응이 빠르며, 수득률이 높고 고순도의 중합체를 얻을 수 있으며, 중합체를 그대로 취급할 수 있는 것이 장점이다. 그러나 중합계의 발열이 강하여 온도조절이 어렵고, 중합체의 분자량분포가 넓어지며, 중합체의 석출이 쉽지 않은 단점도 있다. 액체상 또는 기체상의 단위체중합에 잘 이용된다. 축합중합에 이용할 때는 강하게 발열하는 일은 적다. 중합반응의 기초적인 연구를 위해 실험실에서 시행되며, 공업적으로도 유기유리로서의 아크릴수지 제조 등에 이용된다.
































소개글