
-
1
-
2
-
3
-
4
-
5
-
6
-
7
-
8
-
9
-
10
-
11
-
12
-
13
-
14
-
15
-
16
-
17
-
18
-
19
-
20
-
21
-
22
-
23
-
24
-
25
-
26
-
27
-
28
-
29
-
30
-
31
-
32
-
33
-
34
-
35
-
36
-
37
-
38
-
39
-
40
-
41
-
42
-
43
-
44
-
45
-
46
-
47


목차
1. 서론
2. 이론
3. 실험 장치
4. 실험 방법
5. 실험 결과
6. 고찰
7. 결론
8. 참고 문헌
9. 건의 사항
2. 이론
3. 실험 장치
4. 실험 방법
5. 실험 결과
6. 고찰
7. 결론
8. 참고 문헌
9. 건의 사항
본문내용
0.786mol%로 나타나 있는데 이론상으로는 0.612mol%가 된다. 유출량도 이론상 559.8g 과 실제 520g 사이에는 다소 차이가 있었다.
최초 실험 준비 단계에서 조교에게 액의 양과 조성을 알아봤을 때 부피비 1:1로 4L가 들어 있다고 했다. 하지만 아무래도 스틸 내에는 4L의 원료가 들어있지 않았던 것 같다. 이전 실험조에서 그 실험을 했었고 우리의 실험이 그 연장선상에 있었던 것 같은 생각이 든다. 따라서 제품의 양의 차이는 여기서 비롯된 것 같다.
사실상 50분간의 실험시간동안 조성의 변화가 거의 없었다. 저비점 성분인 메탄올은 시간이 지남에 따라 조성이 올라가야 되는데 오히려 떨어졌다. 이 부분에 대해서는 온도에 대해 좀 따져봐야 할 것 같다. 스틸내 온도는 데이터에서 볼 수 있듯이 약간의 변화만을 수반했다. 하지만 탑상부의 온도변화는 계속 진행되었고 마지막에는 78℃까지 올라갔다. 이 때 물의 증기가 같이 증발되어 제품의 순도에 영향을 미친 것 같은 생각이다.
실험실에 있는 정류탑의 이론단수를 알아보지 못했다. 전환류의 용액에 대해서는 조작선의 방정식이 y=x 이므로 평형곡선과 x=y 선상에서 최소 이론 단수만 구해주면 됐다. 내가 증류 조작을 통해서 순수한 제품을 얻는데 까지 실험을 하지 못했기 때문에 각각의 조성은 내가 임의로 선택했다.
최소 이론단수를 구하는 식은 Fenske 식이었는데 사실상 이 식에서 가장 중요한 인자가 비휘발도이다. 물과 메탄올의 비휘발도는 내가 어떤 문헌에서 얻은 자료를 통해 대입하여 값을 구하였다. 만약 최소 이론 단수와 실제 값에 차이가 있다면 상대 휘발도의 영향일 것이다.
Ⅷ. 결 론
이번 실험은 증류에 관한한 모든 지식을 필요로 했던 실험이라고 말해도 될 만큼 많은 사전 지식들을 필요로 했다.
우선 증류에 관한 문제를 해결하기 위해 기/액 평형의 열역학적 개념들을 먼저 접해야 했고 그와 관련된 라울의 법칙, 상률, Duhem의 정리 같은 지식들이 필요했다. 분리공정의 하나인 증류조작은 기/액 평형에서 출발하기 때문이다.
다음으로 회분식 증류공정의 Rayleigh식
을 이용하기 위해 증류에 방법에 대한 이론이 필요했다. 단증류에서부터 시작하여 연속단증류에 이르기 까지 이해가 필요했다.
이 식의 변형에서는 상대휘발도를 알아야 그 값을 윗 식에 대입하여 새로운 식을 얻어낼 수가 있었다.
회분식 단증류만을 취급일 경우 정류탑의 단수는 생각할 필요가 없었을 것이다. 다단식 회분식 증류탑이라는 제목에서도 알 수 있듯이 이론단수를 얻어내기 위해서는 정류에 지식을 필요로 했다. 그리고 환류조작이 중요하게 작용했다.
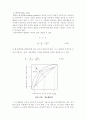
환류액의 몰수를 유출액의 몰수로 나눈 이 값은 우리가 행한 실험에서는 전환류 조작이 이루어져 R의 값이 ∞ 가 되었다. 따라서 농축선, 회수선과 같은 조작선의 방정식이 y=x가 되면서 최소 이론 단수만 가지고 증류탑의 단수를 계산할 수 있었다.
최소 이론단수를 구하는 식은
와 같고 조작선의 방정식 없이 조성의 값들과 메탄올에 대한 물의 상대휘발도 값만으로 최소 이론 단수를 구할 수 있었다. 하지만 이 식은 전환류 조작이 아닐 경우는 이상용액이 아닌 이상 실제단수로써 작용할 수 없다.
실제 화학공정에서는 분리공정이 굉장히 중요하게 작용하고 사용빈도도 굉장히 높다.
이번 실험은 열역학 지식을 바탕으로 만들어진 P-x,y (압력과 조성) 또는
T-x,y (온도와 조성) 의 diagram을 이용하여 그 그래프 선상에 조작선을 작도하고 정류탑의 이론단수를 측정하여 나아가서는 탑의 높이나 직경까지도 설계할 수 있는 능력을 배양할 수 있는 실험이었다.
▶ 정 리
증류 : 끓는점의 차이를 이용하여 가열 분리하는 조작
라울의 법칙 : 이상 용액이라 할 때, 성분 A의 증기 분압 PA는 그 성분의 증기압 PA와 액상에서 몰분율 XA를 곱한 것과 같다.
PA = PAXA PB = PBXB = PB(1=XA)
단증류 : 일정량의 혼합 액체를 증류 조작으로 나오는 증기를 응축기에서 액화하여 목적 성분을 얻는 회분식 증류 방식이다.
정류 : 탑 안에 여러 개의 단을 만들어 상승하는 증기와 내려오는 액체가 계속적이고 반복적으로 접촉하게 하여 탑 위에서는 낮은 끓는점 성분이 얻어지고, 탑 아래에서는 높은 끓는점 성분이 얻어질 수 물질 전달 조작이다.
정류 물질 수지
총괄 물지 수지 : F =D + B
낮은 끓는점 성분 물질 수지 : F xF=DxD+BxB
농축부 조작 방정식 : y n+1= R/R+1xn+xD/R+1
환류비 : R=L/D
회수부 조작 방정식 : y=B+V/Vx+B/V
급액단 조작 방정식 : y=-1-f/f x+xf/f
메카베-틸레법에 의한 이론단수 구하기
1.x축을 액상의 조성으로 하고, y축을 기상의 조성으로 하여 정 사각형을 그리고, 대각선을 긋는다.
2.기액 평형선을 그린다.
3.농축부, 원료공급, 회수부의 각 조작선을 그린다.
4.기액 평형선과 각 조작선과의 사이에서 점 (xD, xD)을 시작으로하여 점 (xB, xB)가 지나는 곳까지 직각삼각형모양으로 그린다.
5.삼각형 수가 이론 단수이며 원료 공급 조작선과 만나는 단은 원료 공급단이며, 그 위가 농축부의 이론 단수이고, 아래가 회수부의 이론 단수이다.Ⅹ. 참고문헌
1. 참고문헌
화 학 공 학 박 동 원 편저 동아대학교 출판부
공업화학을 위한 권 창 오 , 김 문 갑 도서출판 동 화
화 학 공 학 김 성 종 , 김 홍 수
화공 단위 조작 서 명 교 , 송 주 영 도서출판 대 웅
Third edition 최 용 희
2. 참고웹사이트
http:// www.chemscript.net인터넷 화학 공학
www.hsem.co.kr한성 ENG & MFG
www.samjinuc.com 산진unichem
. 건의사항
2학년 때부터 배워온 여러 가지 실험들을 다시 한번 되짚어 보는 시간이었다. 다만 한 가지, 상부에서 나온 제품의 무게를 측정하는 저울이 실험실엔 어울릴법하지 않은 바늘저울 이었다 는 것이 다소 마음에 걸린다. 비록 상부제품의 양을 측정하는 것이 그렇게 중요한 인자는 아니지만, 되도록이면 전자저울로 바뀌었으면 하는 바램이다.
최초 실험 준비 단계에서 조교에게 액의 양과 조성을 알아봤을 때 부피비 1:1로 4L가 들어 있다고 했다. 하지만 아무래도 스틸 내에는 4L의 원료가 들어있지 않았던 것 같다. 이전 실험조에서 그 실험을 했었고 우리의 실험이 그 연장선상에 있었던 것 같은 생각이 든다. 따라서 제품의 양의 차이는 여기서 비롯된 것 같다.
사실상 50분간의 실험시간동안 조성의 변화가 거의 없었다. 저비점 성분인 메탄올은 시간이 지남에 따라 조성이 올라가야 되는데 오히려 떨어졌다. 이 부분에 대해서는 온도에 대해 좀 따져봐야 할 것 같다. 스틸내 온도는 데이터에서 볼 수 있듯이 약간의 변화만을 수반했다. 하지만 탑상부의 온도변화는 계속 진행되었고 마지막에는 78℃까지 올라갔다. 이 때 물의 증기가 같이 증발되어 제품의 순도에 영향을 미친 것 같은 생각이다.
실험실에 있는 정류탑의 이론단수를 알아보지 못했다. 전환류의 용액에 대해서는 조작선의 방정식이 y=x 이므로 평형곡선과 x=y 선상에서 최소 이론 단수만 구해주면 됐다. 내가 증류 조작을 통해서 순수한 제품을 얻는데 까지 실험을 하지 못했기 때문에 각각의 조성은 내가 임의로 선택했다.
최소 이론단수를 구하는 식은 Fenske 식이었는데 사실상 이 식에서 가장 중요한 인자가 비휘발도이다. 물과 메탄올의 비휘발도는 내가 어떤 문헌에서 얻은 자료를 통해 대입하여 값을 구하였다. 만약 최소 이론 단수와 실제 값에 차이가 있다면 상대 휘발도의 영향일 것이다.
Ⅷ. 결 론
이번 실험은 증류에 관한한 모든 지식을 필요로 했던 실험이라고 말해도 될 만큼 많은 사전 지식들을 필요로 했다.
우선 증류에 관한 문제를 해결하기 위해 기/액 평형의 열역학적 개념들을 먼저 접해야 했고 그와 관련된 라울의 법칙, 상률, Duhem의 정리 같은 지식들이 필요했다. 분리공정의 하나인 증류조작은 기/액 평형에서 출발하기 때문이다.
다음으로 회분식 증류공정의 Rayleigh식
을 이용하기 위해 증류에 방법에 대한 이론이 필요했다. 단증류에서부터 시작하여 연속단증류에 이르기 까지 이해가 필요했다.
이 식의 변형에서는 상대휘발도를 알아야 그 값을 윗 식에 대입하여 새로운 식을 얻어낼 수가 있었다.
회분식 단증류만을 취급일 경우 정류탑의 단수는 생각할 필요가 없었을 것이다. 다단식 회분식 증류탑이라는 제목에서도 알 수 있듯이 이론단수를 얻어내기 위해서는 정류에 지식을 필요로 했다. 그리고 환류조작이 중요하게 작용했다.
환류액의 몰수를 유출액의 몰수로 나눈 이 값은 우리가 행한 실험에서는 전환류 조작이 이루어져 R의 값이 ∞ 가 되었다. 따라서 농축선, 회수선과 같은 조작선의 방정식이 y=x가 되면서 최소 이론 단수만 가지고 증류탑의 단수를 계산할 수 있었다.
최소 이론단수를 구하는 식은
와 같고 조작선의 방정식 없이 조성의 값들과 메탄올에 대한 물의 상대휘발도 값만으로 최소 이론 단수를 구할 수 있었다. 하지만 이 식은 전환류 조작이 아닐 경우는 이상용액이 아닌 이상 실제단수로써 작용할 수 없다.
실제 화학공정에서는 분리공정이 굉장히 중요하게 작용하고 사용빈도도 굉장히 높다.
이번 실험은 열역학 지식을 바탕으로 만들어진 P-x,y (압력과 조성) 또는
T-x,y (온도와 조성) 의 diagram을 이용하여 그 그래프 선상에 조작선을 작도하고 정류탑의 이론단수를 측정하여 나아가서는 탑의 높이나 직경까지도 설계할 수 있는 능력을 배양할 수 있는 실험이었다.
▶ 정 리
증류 : 끓는점의 차이를 이용하여 가열 분리하는 조작
라울의 법칙 : 이상 용액이라 할 때, 성분 A의 증기 분압 PA는 그 성분의 증기압 PA와 액상에서 몰분율 XA를 곱한 것과 같다.
PA = PAXA PB = PBXB = PB(1=XA)
단증류 : 일정량의 혼합 액체를 증류 조작으로 나오는 증기를 응축기에서 액화하여 목적 성분을 얻는 회분식 증류 방식이다.
정류 : 탑 안에 여러 개의 단을 만들어 상승하는 증기와 내려오는 액체가 계속적이고 반복적으로 접촉하게 하여 탑 위에서는 낮은 끓는점 성분이 얻어지고, 탑 아래에서는 높은 끓는점 성분이 얻어질 수 물질 전달 조작이다.
정류 물질 수지
총괄 물지 수지 : F =D + B
낮은 끓는점 성분 물질 수지 : F xF=DxD+BxB
농축부 조작 방정식 : y n+1= R/R+1xn+xD/R+1
환류비 : R=L/D
회수부 조작 방정식 : y=B+V/Vx+B/V
급액단 조작 방정식 : y=-1-f/f x+xf/f
메카베-틸레법에 의한 이론단수 구하기
1.x축을 액상의 조성으로 하고, y축을 기상의 조성으로 하여 정 사각형을 그리고, 대각선을 긋는다.
2.기액 평형선을 그린다.
3.농축부, 원료공급, 회수부의 각 조작선을 그린다.
4.기액 평형선과 각 조작선과의 사이에서 점 (xD, xD)을 시작으로하여 점 (xB, xB)가 지나는 곳까지 직각삼각형모양으로 그린다.
5.삼각형 수가 이론 단수이며 원료 공급 조작선과 만나는 단은 원료 공급단이며, 그 위가 농축부의 이론 단수이고, 아래가 회수부의 이론 단수이다.Ⅹ. 참고문헌
1. 참고문헌
화 학 공 학 박 동 원 편저 동아대학교 출판부
공업화학을 위한 권 창 오 , 김 문 갑 도서출판 동 화
화 학 공 학 김 성 종 , 김 홍 수
화공 단위 조작 서 명 교 , 송 주 영 도서출판 대 웅
Third edition 최 용 희
2. 참고웹사이트
http:// www.chemscript.net인터넷 화학 공학
www.hsem.co.kr한성 ENG & MFG
www.samjinuc.com 산진unichem
. 건의사항
2학년 때부터 배워온 여러 가지 실험들을 다시 한번 되짚어 보는 시간이었다. 다만 한 가지, 상부에서 나온 제품의 무게를 측정하는 저울이 실험실엔 어울릴법하지 않은 바늘저울 이었다 는 것이 다소 마음에 걸린다. 비록 상부제품의 양을 측정하는 것이 그렇게 중요한 인자는 아니지만, 되도록이면 전자저울로 바뀌었으면 하는 바램이다.
































































소개글