목차
1. 실험제목
2. 실험목적 및 개요
3. 실험원리
4. 참고자료 및 용어정리
5. 실험과정
6. 실험결과
1) pH meter의 보정
2) NaOH 용액에 따른 pH 변화량 및 지시약 색깔 변화
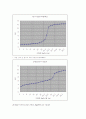
3) 위의 결과를 pH 적정 곡선으로 나타내어라. 가해진 NaOH 부피에 대한 pH 의 적정곡선을 그리되 가로축은 가해진 NaOH의 양, 세로축은 pH의 변화량을 표시하라.
4) HCl과 식초의 농도를 구하라. (NaOH의 농도 =0.1N)
5) HCl을 NaOH로 적정했을 때와 CH3COOH를 NaOH로 적정했을 때 종말점에서의 pH는 각각 얼마인며, 두 경우에 적정곡선의 모양이 다른 이유는 무엇인가?
6) CH3COOH의 이온화상수 (산해리상수)를 구하시오.
7) 산의 농도를 지시약의 종말점으로 구한 것과 , 당량점으로 구할 때의 오차는 얼마나 되는가?
7. 토론 및 토의
8. 더 좋은 결과를 위해..
2. 실험목적 및 개요
3. 실험원리
4. 참고자료 및 용어정리
5. 실험과정
6. 실험결과
1) pH meter의 보정
2) NaOH 용액에 따른 pH 변화량 및 지시약 색깔 변화
3) 위의 결과를 pH 적정 곡선으로 나타내어라. 가해진 NaOH 부피에 대한 pH 의 적정곡선을 그리되 가로축은 가해진 NaOH의 양, 세로축은 pH의 변화량을 표시하라.
4) HCl과 식초의 농도를 구하라. (NaOH의 농도 =0.1N)
5) HCl을 NaOH로 적정했을 때와 CH3COOH를 NaOH로 적정했을 때 종말점에서의 pH는 각각 얼마인며, 두 경우에 적정곡선의 모양이 다른 이유는 무엇인가?
6) CH3COOH의 이온화상수 (산해리상수)를 구하시오.
7) 산의 농도를 지시약의 종말점으로 구한 것과 , 당량점으로 구할 때의 오차는 얼마나 되는가?
7. 토론 및 토의
8. 더 좋은 결과를 위해..
본문내용
0ml = 0.1N * 24.0ml) , ((x)=), ((x)=0.120N)
위에서 구해진 각각의 값들을 바탕으로 오차율을 구해보면, (실험치는 종말점, 이론치는 당량점에서 구한 산 농도이므로)
-. HCl의 경우:
x 100(%)= 0.43%
-. CH3COOH의 경우:
x 100(%)= 0.83%
위로부터, 종말점에 의해 구한 방법과 당량점에 의해 구한 방법은 오차율 1% 미만으로 거의 유사한 결과를 얻을 수 있었다.
7. 토론 및 토의
--> 실험을 통해서 산-염기의 중화 반응에 대해 알아볼 수 있었다. 단순히 생각해서 산을 (+)로 보고 염기를 (-)로 본다면, (+)의 개수와 (-)의 개수가 동일해진다면 이는 “0”인 상태, 즉 산도 염기도 아닌 중성상태로 나타낸다. 반면, (+)의 개수가 많다면 산성, (-)의 개수가 많다면 염기성을 나타낸다고 볼 수 있다. 이런 산과 염기, 중화 반응을 볼 수 있는 일련의 과정은 "pH Meter“라는 pH 측정 장치와 "메틸오렌지, 페놀프탈레인” 지시약을 통해 확인할 수 있었다. pH 가 낮을수록 산성을 나타낸다. 이는 pH 에 대한 지식이 전혀 없더라도 강산인 HCl과 약산인 CH3COOH의 pH를 비교해 봄으로써 알 수 있다. 초기의 pH는 HCl의 경우 1.15, CH3COOH의 경우 2.79를 나타내는데, 여기서 강산의 pH가 더 낮으므로 산성이 강한 것임을 알 수 있다.
HCl의 초기상태 pH 1.15 일 경우를 완전한 (+)로 생각한다면, 이 용액에 염기 (NaOH)를 가함으로써 점점 (+)의 힘을 잃고 (-)의 힘을 나타내게 된다. 그러다가 어느 순간 (+)와 (-)의 힘이 같아지게 되는데 이때 “중화”하게 되는 것이다. “(+)(-)”인 상태에서 메틸오렌지 지시약의 색깔이 “무색->주황핵”으로 변화하는 것을 관찰할 수 있었다. 그리고 여기서부터 염기 (NaOH)의 농도가 높아짐에 따라 pH 값은 높아졌고, pH가 급상승했을 때 지시약은 “주황색->노랑색”으로 바뀌어 이때 염기의 성질이 산의 성질보다 강해지는 지점으로 이해할 수 있었다. 이를 달리 말하면, 색깔이 바뀌기 바로 직전이 산과 염기의 화학량이 같아지는 지점이 되는 것이며, 이 지점은 종말점을 일컫는 말이 된다. 이때, 지시약의 색깔의 변화를 관찰함으로써 대략의 산의 농도 값을 측정할 수 있었다. (단 NV= N'V'에서 V, N', V'의 값을 미리 알고 있거나 실험을 통해서 측정 가능해야 한다.)
이론적으로는 당량점을 예측함으로써 산의 농도를 측정할 수 있다. 강산과 강염기가 만나는 경우의 중화 지점은 pH가 7인 지점이 되며, 약산과 강염기가 만나는 경우의 중화 지저은 pH가 7보다 큰 값을 나타는 지점이 된다. 따라서 HCl과 NaOH가 만나는 경우의 당량점은 pH=7인 지점, CH3COOH와 NaOH가 만나는 경우의 당량점은 pH>7인 지점이 바로 당량점이 되는데, 실험에서는 두 경우 모두 정확한 실험값을 얻어낼 수는 없었다. 두 경우 모두 0.2ml/방울 단위로 NaOH를 가했기 때문에 그 중간 값에서 pH의 측정값이 존재하였기 때문에 완벽하게 정확한 값을 얻어낼 수는 없었다. 더군다나, CH3COOH와 NaOH를 섞는 경우, pH값이 7보다 큰 값으로 예측이 되지만, 정확한 위치를 알 수는 없기 때문에, 추정하는 위치로 예상할 수밖에 없었다. 하지만, 이렇게 측정을 해서 나타나는 결과 값은 종말점에서 측정한 결과 값과 큰 차이를 나타내지 않았으므로(오차율 1% 미만), 믿을만한 자료가 된다고 할 수 있다.
CH3COOH의 산해리상수 값을 측정값을 바탕으로 한 값(1.664 x 10-3 ) 에서는, 실제 문헌 값인 CH3COOH의 산해리 상수=1.75 x 10-5 에 비해 100배 정도 큰 값이 나왔으며, 이는 당량점을 잘못 지정하여 나온 값이라고 추정된다. 당량점이 정확하게 어느 지점에서 나타날 것인지에 대한 자료가 있으면 좀 더 정확한 계산이 가능할 것 같다.
이번 실험을 통해서 산과 염기, 산-염기 중화반응, 중화적정, 산해리상수 등 이론으로만 접해보던 수식들을 직접 실행해 볼 수 있었고, 이를 바탕으로 더욱 깊이 있는 수업이 되지 않았나 생각해본다.
8. 더 좋은 결과를 위해..
1) 실험 진행시 pH4, pH7, pH10 용액 보정을 할 때 pH Meter 의 전극을 증류수에 충분하게 헹구어 주어야 발생할 수 있는 오차를 최소화 할 수 있다. 실험에 큰 영향을 미치지는 않지만, 각 단계마다 증류수를 갈아주어 측정하면 좀더 정교한 값을 얻을 수 있을 것이다.
2) 산 용액에 염기용액을 넣어주는 과정에서 어느 순간 pH 가 급상승하는 부분이 있다. 이 수치를 미리 염두해 두고 r 때부터 NaOH를 섞는 양을 매우 적게 하여 중화 적정 및 산에서 염기로의 변화 과정을 정확히 측정할 수 있다. 실제 실험에서는 0.2ml 단위로 수치를 측정하였으나, 0.1ml 내지는 0.05ml 등 더 미세한 단위로 측정하는 것이 정확한 값을 산출하는데 보다 효율적인 방법이 될 것으로 기대된다.
3) pM Meter를 읽을 때 반드시 “s"가 나타날 때까지 기다린다. 이때가 안정화된 이후의 상태이므로 그 전에 pH를 읽지 않도록 한다.
4) 실험에 쓰이는 용액은 농도가 낮지만 (실험에서는 미지농도) 피부에 닿게되면 위험할 수 있으므로 보안경과 장갑을 착용하여 실험에 임하도록 한다.
9. 참고문헌:
-. 네이버 백과사전 (http://100.naver.com/100.nhn?docid=85698)
-. [General Chemistry] (2006년), R.Chang, 자유아카데미, p.600~621
-. [화학실험] (제7판), 아주대학교 자연과학대학 화학과, 아주대학교 출판부 p.93~96
-. [분석화학] (제5판), 이용근, 박정학 외, 회중당 p.
-. [최신일반화학] (2000년), 화교재편찬위원회, 동화기술
-. [일반물리학실험] (2003년), 한국물리학회, 청문각
-. 인터넷 엠파스 백과사전 (http://search.empas.com/search/encdic)
-. 인터넷 위키백과 (http://ko.wikipedia.org/)
위에서 구해진 각각의 값들을 바탕으로 오차율을 구해보면, (실험치는 종말점, 이론치는 당량점에서 구한 산 농도이므로)
-. HCl의 경우:
x 100(%)= 0.43%
-. CH3COOH의 경우:
x 100(%)= 0.83%
위로부터, 종말점에 의해 구한 방법과 당량점에 의해 구한 방법은 오차율 1% 미만으로 거의 유사한 결과를 얻을 수 있었다.
7. 토론 및 토의
--> 실험을 통해서 산-염기의 중화 반응에 대해 알아볼 수 있었다. 단순히 생각해서 산을 (+)로 보고 염기를 (-)로 본다면, (+)의 개수와 (-)의 개수가 동일해진다면 이는 “0”인 상태, 즉 산도 염기도 아닌 중성상태로 나타낸다. 반면, (+)의 개수가 많다면 산성, (-)의 개수가 많다면 염기성을 나타낸다고 볼 수 있다. 이런 산과 염기, 중화 반응을 볼 수 있는 일련의 과정은 "pH Meter“라는 pH 측정 장치와 "메틸오렌지, 페놀프탈레인” 지시약을 통해 확인할 수 있었다. pH 가 낮을수록 산성을 나타낸다. 이는 pH 에 대한 지식이 전혀 없더라도 강산인 HCl과 약산인 CH3COOH의 pH를 비교해 봄으로써 알 수 있다. 초기의 pH는 HCl의 경우 1.15, CH3COOH의 경우 2.79를 나타내는데, 여기서 강산의 pH가 더 낮으므로 산성이 강한 것임을 알 수 있다.
HCl의 초기상태 pH 1.15 일 경우를 완전한 (+)로 생각한다면, 이 용액에 염기 (NaOH)를 가함으로써 점점 (+)의 힘을 잃고 (-)의 힘을 나타내게 된다. 그러다가 어느 순간 (+)와 (-)의 힘이 같아지게 되는데 이때 “중화”하게 되는 것이다. “(+)(-)”인 상태에서 메틸오렌지 지시약의 색깔이 “무색->주황핵”으로 변화하는 것을 관찰할 수 있었다. 그리고 여기서부터 염기 (NaOH)의 농도가 높아짐에 따라 pH 값은 높아졌고, pH가 급상승했을 때 지시약은 “주황색->노랑색”으로 바뀌어 이때 염기의 성질이 산의 성질보다 강해지는 지점으로 이해할 수 있었다. 이를 달리 말하면, 색깔이 바뀌기 바로 직전이 산과 염기의 화학량이 같아지는 지점이 되는 것이며, 이 지점은 종말점을 일컫는 말이 된다. 이때, 지시약의 색깔의 변화를 관찰함으로써 대략의 산의 농도 값을 측정할 수 있었다. (단 NV= N'V'에서 V, N', V'의 값을 미리 알고 있거나 실험을 통해서 측정 가능해야 한다.)
이론적으로는 당량점을 예측함으로써 산의 농도를 측정할 수 있다. 강산과 강염기가 만나는 경우의 중화 지점은 pH가 7인 지점이 되며, 약산과 강염기가 만나는 경우의 중화 지저은 pH가 7보다 큰 값을 나타는 지점이 된다. 따라서 HCl과 NaOH가 만나는 경우의 당량점은 pH=7인 지점, CH3COOH와 NaOH가 만나는 경우의 당량점은 pH>7인 지점이 바로 당량점이 되는데, 실험에서는 두 경우 모두 정확한 실험값을 얻어낼 수는 없었다. 두 경우 모두 0.2ml/방울 단위로 NaOH를 가했기 때문에 그 중간 값에서 pH의 측정값이 존재하였기 때문에 완벽하게 정확한 값을 얻어낼 수는 없었다. 더군다나, CH3COOH와 NaOH를 섞는 경우, pH값이 7보다 큰 값으로 예측이 되지만, 정확한 위치를 알 수는 없기 때문에, 추정하는 위치로 예상할 수밖에 없었다. 하지만, 이렇게 측정을 해서 나타나는 결과 값은 종말점에서 측정한 결과 값과 큰 차이를 나타내지 않았으므로(오차율 1% 미만), 믿을만한 자료가 된다고 할 수 있다.
CH3COOH의 산해리상수 값을 측정값을 바탕으로 한 값(1.664 x 10-3 ) 에서는, 실제 문헌 값인 CH3COOH의 산해리 상수=1.75 x 10-5 에 비해 100배 정도 큰 값이 나왔으며, 이는 당량점을 잘못 지정하여 나온 값이라고 추정된다. 당량점이 정확하게 어느 지점에서 나타날 것인지에 대한 자료가 있으면 좀 더 정확한 계산이 가능할 것 같다.
이번 실험을 통해서 산과 염기, 산-염기 중화반응, 중화적정, 산해리상수 등 이론으로만 접해보던 수식들을 직접 실행해 볼 수 있었고, 이를 바탕으로 더욱 깊이 있는 수업이 되지 않았나 생각해본다.
8. 더 좋은 결과를 위해..
1) 실험 진행시 pH4, pH7, pH10 용액 보정을 할 때 pH Meter 의 전극을 증류수에 충분하게 헹구어 주어야 발생할 수 있는 오차를 최소화 할 수 있다. 실험에 큰 영향을 미치지는 않지만, 각 단계마다 증류수를 갈아주어 측정하면 좀더 정교한 값을 얻을 수 있을 것이다.
2) 산 용액에 염기용액을 넣어주는 과정에서 어느 순간 pH 가 급상승하는 부분이 있다. 이 수치를 미리 염두해 두고 r 때부터 NaOH를 섞는 양을 매우 적게 하여 중화 적정 및 산에서 염기로의 변화 과정을 정확히 측정할 수 있다. 실제 실험에서는 0.2ml 단위로 수치를 측정하였으나, 0.1ml 내지는 0.05ml 등 더 미세한 단위로 측정하는 것이 정확한 값을 산출하는데 보다 효율적인 방법이 될 것으로 기대된다.
3) pM Meter를 읽을 때 반드시 “s"가 나타날 때까지 기다린다. 이때가 안정화된 이후의 상태이므로 그 전에 pH를 읽지 않도록 한다.
4) 실험에 쓰이는 용액은 농도가 낮지만 (실험에서는 미지농도) 피부에 닿게되면 위험할 수 있으므로 보안경과 장갑을 착용하여 실험에 임하도록 한다.
9. 참고문헌:
-. 네이버 백과사전 (http://100.naver.com/100.nhn?docid=85698)
-. [General Chemistry] (2006년), R.Chang, 자유아카데미, p.600~621
-. [화학실험] (제7판), 아주대학교 자연과학대학 화학과, 아주대학교 출판부 p.93~96
-. [분석화학] (제5판), 이용근, 박정학 외, 회중당 p.
-. [최신일반화학] (2000년), 화교재편찬위원회, 동화기술
-. [일반물리학실험] (2003년), 한국물리학회, 청문각
-. 인터넷 엠파스 백과사전 (http://search.empas.com/search/encdic)
-. 인터넷 위키백과 (http://ko.wikipedia.org/)































소개글