목차
1.이 론
1.1.분광학의 원리
1.1.1.마이크로파 분광법
1.1.2.라만 분광법
1.1.3.적외선 분광법
1.1.4.질량 분광법
1.2.광학밀도
1.3.람베르트-베르의 법칙
1.4.비어의 법칙
2.실 험
2.1.실험기구 및 시약
2.1.1.실험기구
2.1.2.시약
2.2.실험방법
2.3.주의사항
2.4.물리상수
3.결 과
3.1.Raw data
3.2.Result
4.고 찰
5.참고문헌
1.1.분광학의 원리
1.1.1.마이크로파 분광법
1.1.2.라만 분광법
1.1.3.적외선 분광법
1.1.4.질량 분광법
1.2.광학밀도
1.3.람베르트-베르의 법칙
1.4.비어의 법칙
2.실 험
2.1.실험기구 및 시약
2.1.1.실험기구
2.1.2.시약
2.2.실험방법
2.3.주의사항
2.4.물리상수
3.결 과
3.1.Raw data
3.2.Result
4.고 찰
5.참고문헌
본문내용
상황에서 O.D.를 알면 그 물질의 용액의 O.D.를 측정함으로써 농도를 구할수 있다.
1.3. 람베르트-베르의 법칙
기체 및 용액에서의 빛의 흡수에 관한 람베르트의 법칙 및 베르의 법칙을 합친 것이다. 기체나 용액에 빛을 쪼인 뒤 통과해 나오는 빛의 세기는 흡수층의 두께와 몰농도의 영향을 받고 기체나 용액의 빛을 흡수하는 정도는 흡수층의 분자수에 비례하고, 희석도나 압력과는 무관하다는 것이다. 입사광의 세기를 , 물질을 통과한 빛의 세기를 , 흡수층의 두께를 d, 농도를 라 하면, 로 표시된다. 를 몰농도르 나타낼 때는 는 흡수계수라 하고, 를 수밀도 (1cm3 당의 분자수)로 나타낼 때는 는 흡수단면적이라 한다. 한편 베르의 법칙은 기체나 용액에서의 흡수의 세기는 흡수층의 빛의 진로내에 있는 분자수에 비례하고, 희석도나 압력과는 무관하다는 것인데, 농도나 압력이 너무 커지면 베르의 법칙이 성립되지 않는 경우가 있다.
1.4. 비어의 법칙
용액의 흡수에 관한 법칙, 용액의 용매가 흡수를 하지 않는 경우에 처음 의 세기의 빛이 농도 c의 용액속을 L 만큼 진행한 때의 빛의 세기 는 다음식으로 나타낼수 있다. 여기서 r은 흡수상수이며, 이 관계를 이용해 광학적으로 용액의 농도를 알 수 있다.
2. 실험 (EXPERIMENT)
2.1. 실험기구 및 시약
2.1.1. 실험기구
UV-Spectrophoto meter, Volumetric flask, Pipette, Erlenmeyer flask
2.1.2. 시약
Hydroxylamine Chloride, Sodium acetate, Distilled water, 10ppm stock solution, 발색약 용액, 미지시료
2.2. 실험방법
가장 먼저 stock solution을 희석시켜 standard solution을 각각 0.5ppm, 1ppm, 2ppm 2.5ppm을 제조하였다. standard solution을 제조하기 위하여 0.5ppm, 1.0ppm, 2.0ppm, 2.5ppm에 각각 5ml, 10ml, 20ml, 25ml의 stock solution을 취하여 넣어주고 각각 농도의 solution을 만들었다.. 그 다음 위 standard solution 25ml에 Hydroxylamine Chloride solution 1ml, 1.2M Sodium acetate solution 10ml, 발색약 용액 10ml을 넣고 위 용액의 합이 100ml이 되도록 증류수를 넣었다. 그리고 standard solution의 흡광도를 측정하여 calibration curve를 작성하였다. 저농도 미지시료(A) 25ml와 고농도 미지시료(B) 2.5ml를 위와 같은 방법으로 처리하여 용액을 만들고 마지막으로는 위에서 만든 미지시료 A, B용액의 흡광도를 측정하여 미지시료의 농도를 분석하였다.
2.3. 주의사항
발색약은 실험하기 바로전에 넣고 오래 방치하지 않은 상태에서 실험 할 수 있 도록 한다.
100ml로 mass up할 때는 부피플라스크를 사용하도록 한다.
standard solution을 제조하기 위하여 0.5ppm, 1.0ppm, 2.0ppm, 2.5ppm에 각각 5ml, 10ml, 20ml, 25ml의 stock solution을 취하여 넣어주고 각각 농도의 solution을 만든다.
2.4. 물리상수
Table 1. 물리상수
분자량(g/mol)
밀도(g/ml)
녹는점(℃)
끓는점(℃)
CHCOONa
82.03
1.4
58
-
3. 결과 (RESULT)
3.1. Raw data
Table 2. Raw data
standard solution
흡광도
0.5ppm
0.1
1.0ppm
0.195
2.0ppm
0.385
2.5ppm
0.482
시료 A
0.112
시료 B
0.088
3.2. Result
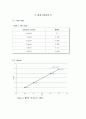
Figure 4. 흡광도 대 농도의 그래프
-미지시료 A의 농도
y = 0.1908x + 0.0043
y = 0.112 이므로 x = 0.5645 이다.
따라서 미지시료의 농도는 0.5645 × 4 = 2.258ppm
-미지시료 B의 농도
y = 0.1908x + 0.0043
y = 0.088 이므로 x = 0.4387 이다.
따라서 미지시료의 농도는 0.4387 × 40 = 17.55ppm
4. 고찰 및 토론 (DISCUSSION)
이번 실험은 용액의 농도와 흡광도 사이의 관계를 결정하고, 그 과정을 이해하는데 목적이 있었다. UV-Spectrophoto meter에 쓰이는 cell은 투명한 면과 반투명한 면으로 되어있어 빛을 한 방향으로만 투과하여 투과한 빛의 광도를 측정하여 흡광도를 이용해 농도를 알아보는 방식이었다. 이는 농도가 진해지면 반대쪽에서 보이는 빛의 세기가 약해짐을 알 수 있다. 이 실험은 먼저 농도를 알고 있는 시료들의 흡광도를 각각 측정한 다음, 그 값을 통하여 y축을 흡광도, x축을 농도로 하는 그래프를 그려서 기울기값 과 절편값을 구하였다. 우리가 실험한 값으로 구한 식은 y = 0.1908 + 0.0043 이었다. 위의 식을 이용하여 흡광도가 주어져 있는 미지시료(A)와 (B)의 농도를 구하였다. 일단 y에 측정된 흡광도를 대입하여 x값을 구하고 이 값을 희석배수로 다시 곱해주어 우리가 구하려는 미지시료의 농도를 구하였다. 흡광도를 대입하여 구한 결과 미지시료 A의 농도는 0.5645ppm, 미지시료 B의 농도는 0.4387ppm이다. 하지만 우리는 실험상 고농도의 시료가 빛을 투과 시키지 못할 것이기 때문에 A를 25/100ml로, B를 2.5/10ml로 희석시켰기 때문에 A의 값은 스탠다드 용액 모두 4의 희석배수를 곱하여 계산하였고, B의 값에 40의 희석배수를 곱하여, A의 농도는 2.258ppm이란 것과 B의 농도는 17.55라는 값을 구하게 되었다.
5. 참고문헌 (REPERENCE)
1. 분석화학실험교재연구회 자유아카데미 분석화학실험 99~102 (2004)
2. 분석화학교재연구회 자유아카데미 분석화학 제8판 755~927 (2006)
3. http://cafe.naver.com/aromaro/709
4. http://100.naver.com/100.nhn?docid=79319
1.3. 람베르트-베르의 법칙
기체 및 용액에서의 빛의 흡수에 관한 람베르트의 법칙 및 베르의 법칙을 합친 것이다. 기체나 용액에 빛을 쪼인 뒤 통과해 나오는 빛의 세기는 흡수층의 두께와 몰농도의 영향을 받고 기체나 용액의 빛을 흡수하는 정도는 흡수층의 분자수에 비례하고, 희석도나 압력과는 무관하다는 것이다. 입사광의 세기를 , 물질을 통과한 빛의 세기를 , 흡수층의 두께를 d, 농도를 라 하면, 로 표시된다. 를 몰농도르 나타낼 때는 는 흡수계수라 하고, 를 수밀도 (1cm3 당의 분자수)로 나타낼 때는 는 흡수단면적이라 한다. 한편 베르의 법칙은 기체나 용액에서의 흡수의 세기는 흡수층의 빛의 진로내에 있는 분자수에 비례하고, 희석도나 압력과는 무관하다는 것인데, 농도나 압력이 너무 커지면 베르의 법칙이 성립되지 않는 경우가 있다.
1.4. 비어의 법칙
용액의 흡수에 관한 법칙, 용액의 용매가 흡수를 하지 않는 경우에 처음 의 세기의 빛이 농도 c의 용액속을 L 만큼 진행한 때의 빛의 세기 는 다음식으로 나타낼수 있다. 여기서 r은 흡수상수이며, 이 관계를 이용해 광학적으로 용액의 농도를 알 수 있다.
2. 실험 (EXPERIMENT)
2.1. 실험기구 및 시약
2.1.1. 실험기구
UV-Spectrophoto meter, Volumetric flask, Pipette, Erlenmeyer flask
2.1.2. 시약
Hydroxylamine Chloride, Sodium acetate, Distilled water, 10ppm stock solution, 발색약 용액, 미지시료
2.2. 실험방법
가장 먼저 stock solution을 희석시켜 standard solution을 각각 0.5ppm, 1ppm, 2ppm 2.5ppm을 제조하였다. standard solution을 제조하기 위하여 0.5ppm, 1.0ppm, 2.0ppm, 2.5ppm에 각각 5ml, 10ml, 20ml, 25ml의 stock solution을 취하여 넣어주고 각각 농도의 solution을 만들었다.. 그 다음 위 standard solution 25ml에 Hydroxylamine Chloride solution 1ml, 1.2M Sodium acetate solution 10ml, 발색약 용액 10ml을 넣고 위 용액의 합이 100ml이 되도록 증류수를 넣었다. 그리고 standard solution의 흡광도를 측정하여 calibration curve를 작성하였다. 저농도 미지시료(A) 25ml와 고농도 미지시료(B) 2.5ml를 위와 같은 방법으로 처리하여 용액을 만들고 마지막으로는 위에서 만든 미지시료 A, B용액의 흡광도를 측정하여 미지시료의 농도를 분석하였다.
2.3. 주의사항
발색약은 실험하기 바로전에 넣고 오래 방치하지 않은 상태에서 실험 할 수 있 도록 한다.
100ml로 mass up할 때는 부피플라스크를 사용하도록 한다.
standard solution을 제조하기 위하여 0.5ppm, 1.0ppm, 2.0ppm, 2.5ppm에 각각 5ml, 10ml, 20ml, 25ml의 stock solution을 취하여 넣어주고 각각 농도의 solution을 만든다.
2.4. 물리상수
Table 1. 물리상수
분자량(g/mol)
밀도(g/ml)
녹는점(℃)
끓는점(℃)
CHCOONa
82.03
1.4
58
-
3. 결과 (RESULT)
3.1. Raw data
Table 2. Raw data
standard solution
흡광도
0.5ppm
0.1
1.0ppm
0.195
2.0ppm
0.385
2.5ppm
0.482
시료 A
0.112
시료 B
0.088
3.2. Result
Figure 4. 흡광도 대 농도의 그래프
-미지시료 A의 농도
y = 0.1908x + 0.0043
y = 0.112 이므로 x = 0.5645 이다.
따라서 미지시료의 농도는 0.5645 × 4 = 2.258ppm
-미지시료 B의 농도
y = 0.1908x + 0.0043
y = 0.088 이므로 x = 0.4387 이다.
따라서 미지시료의 농도는 0.4387 × 40 = 17.55ppm
4. 고찰 및 토론 (DISCUSSION)
이번 실험은 용액의 농도와 흡광도 사이의 관계를 결정하고, 그 과정을 이해하는데 목적이 있었다. UV-Spectrophoto meter에 쓰이는 cell은 투명한 면과 반투명한 면으로 되어있어 빛을 한 방향으로만 투과하여 투과한 빛의 광도를 측정하여 흡광도를 이용해 농도를 알아보는 방식이었다. 이는 농도가 진해지면 반대쪽에서 보이는 빛의 세기가 약해짐을 알 수 있다. 이 실험은 먼저 농도를 알고 있는 시료들의 흡광도를 각각 측정한 다음, 그 값을 통하여 y축을 흡광도, x축을 농도로 하는 그래프를 그려서 기울기값 과 절편값을 구하였다. 우리가 실험한 값으로 구한 식은 y = 0.1908 + 0.0043 이었다. 위의 식을 이용하여 흡광도가 주어져 있는 미지시료(A)와 (B)의 농도를 구하였다. 일단 y에 측정된 흡광도를 대입하여 x값을 구하고 이 값을 희석배수로 다시 곱해주어 우리가 구하려는 미지시료의 농도를 구하였다. 흡광도를 대입하여 구한 결과 미지시료 A의 농도는 0.5645ppm, 미지시료 B의 농도는 0.4387ppm이다. 하지만 우리는 실험상 고농도의 시료가 빛을 투과 시키지 못할 것이기 때문에 A를 25/100ml로, B를 2.5/10ml로 희석시켰기 때문에 A의 값은 스탠다드 용액 모두 4의 희석배수를 곱하여 계산하였고, B의 값에 40의 희석배수를 곱하여, A의 농도는 2.258ppm이란 것과 B의 농도는 17.55라는 값을 구하게 되었다.
5. 참고문헌 (REPERENCE)
1. 분석화학실험교재연구회 자유아카데미 분석화학실험 99~102 (2004)
2. 분석화학교재연구회 자유아카데미 분석화학 제8판 755~927 (2006)
3. http://cafe.naver.com/aromaro/709
4. http://100.naver.com/100.nhn?docid=79319
추천자료
 Fe(철) (페난트로닌법)
Fe(철) (페난트로닌법) (식품화학실험보고서)bertrand법에 의한 환원당 정량
(식품화학실험보고서)bertrand법에 의한 환원당 정량 DNA를 확인 할 수 있는법
DNA를 확인 할 수 있는법 [환경공학실험] 총인(아르코르빈산 환원법) 실험
[환경공학실험] 총인(아르코르빈산 환원법) 실험 [다이오드][포토다이오드][발광다이오드][LED][터널다이오드]다이오드 전압, 다이오드 전류 ...
[다이오드][포토다이오드][발광다이오드][LED][터널다이오드]다이오드 전압, 다이오드 전류 ... [화공기초실험] 어는점 내림법에 의한 분자량 측정(결과레포트)
[화공기초실험] 어는점 내림법에 의한 분자량 측정(결과레포트) 비중측정법
비중측정법 경도측정실험 : 인장시험과 함께 기계적 시험법 중에서 가장 많이 사용되는 시험으로 주로 금...
경도측정실험 : 인장시험과 함께 기계적 시험법 중에서 가장 많이 사용되는 시험으로 주로 금... [방사선] X -ray Photoelectron Spectroscopy [XPS]재료 분석법
[방사선] X -ray Photoelectron Spectroscopy [XPS]재료 분석법 [실험보고서] NH4-N 시험법
[실험보고서] NH4-N 시험법 [분석화학실험] 무게법 분석에 의한 염화이온[Cl-]의 정량 - 실험결과, 토의 및 고찰
[분석화학실험] 무게법 분석에 의한 염화이온[Cl-]의 정량 - 실험결과, 토의 및 고찰 실험 6 - Conjugation 염료의 흡수 스펙트럼의 측정법 설계 및 분석
실험 6 - Conjugation 염료의 흡수 스펙트럼의 측정법 설계 및 분석 [무기화학 및 분석화학 실험] 09[예비]. 그래핀(Graphene) 합성 및 분석 : 그래핀(Graphene)...
[무기화학 및 분석화학 실험] 09[예비]. 그래핀(Graphene) 합성 및 분석 : 그래핀(Graphene)... DNA 농도 측정 및 플라스미드 (plasmid), 전기영동법 (gel electrophorosis)
DNA 농도 측정 및 플라스미드 (plasmid), 전기영동법 (gel electrophorosis)
































소개글