목차
예비:
1. 실험 제목
2. 실험조 및 실험자
3. 실험 목적
4. 실험 이론 및 배경
5. 장치 및 시약
6. 실험 방법
7. 참고 문헌
결과:
1. 실험 제목
2. 실험조 및 실험자
3. 실험 결과
4. 토의 및 고찰 (실험 기본 이론+토의/고찰)
5. 참고 문헌
1. 실험 제목
2. 실험조 및 실험자
3. 실험 목적
4. 실험 이론 및 배경
5. 장치 및 시약
6. 실험 방법
7. 참고 문헌
결과:
1. 실험 제목
2. 실험조 및 실험자
3. 실험 결과
4. 토의 및 고찰 (실험 기본 이론+토의/고찰)
5. 참고 문헌
본문내용
너지 간격을 알 수 있게 된다.
ΔE = ELUMO ― EHOMO = hν = hc /λ (h: 플랑크 상수, c: 빛의 속도, λ: 빛의 파장)
또한 이때 전자는 N/2→n₁(HOMO)에서 N/2+1→n₂(LUMO)로 올라가게 되고,
이로 인한 에너지 변화는 다음과 같다. (N: π전자수)
이 때, 이므로, (c는 빛의 속도)
로 나타낼 수 있고,
여기서 폴리메타인 사슬에 있는 탄소 원자들의 수를 p로 표시하면,
N = p+3 이 되고,
L을 양쪽에 결합길이 1개씩을 더한 질소 원자들 사이에 존재하는 사슬의 길이로 가정하면,
L = (p +3) l 이 되므로, ( l: 사슬을 따라 존재하는 원자들 사이의 결합길이 )
에 대한 식은 다음과 같다.
l=1.39 A=0.139nm로 놓고 (벤젠이나 그와 유사한 결합이 있는 분자의 결합 길이에 해당)
를 나타내면 아래와 같다.
/nm = 63.7
이 때 사슬의 끝에 쉽게 편극이 되는 그룹이 있을 경우(벤젠고리와 같은),
사슬에서 전자들의 퍼텐셜 에너지는 양끝에서 급격히 증가하지 않을 것이고,
이것은 길이 L을 증가시키게 되므로 아래와 같이 나타낼 수 있다.
(a는 주어진 유형에 대한 염료 계열의 상수값. a는 0과 1사이의 값.)
/nm=63.7
이상의 식에서 알 수 있듯이 HOMO 와 LUMO 의 에너지 간격, 즉 에너지의 크기는 빛의 파장인 λ의 크기에 반비례 하고, 빛의 파장 λ의 크기는 폴리메타인 사슬에 있는 탄소 원자들의 수인 p에 비례함을 알 수 있다. 즉, p(폴리메타인 사슬에 있는 탄소 원자들의 수)가 커질수록 빛의 파장인 λ의 값이 커지고, 이러한 λ값의 증가는 에너지 갭의 감소를 유발한다.
여기서 에너지 갭은 HOMO 와 LUMO 사이의 에너지 간격으로 아래 그림과 같다.
====================== ]- 반결합 밴드
====================== LUMO
↑
여기 사이 거리 = 에너지 갭
↓
====================== HOMO ]- 결합 밴드
======================
이러한 결합-반결합 밴드 사이의 거리는 폴리메타인 사슬에 있는 탄소 원자들의 수(p)가 증가 할수록, 즉 π-π 중첩이 더 많이 겹칠수록 (conjugation 정도가 증가할수록) 감소하고, 이것은 conjugation 정도가 높을수록 HOMO 와 LUMO 사이의 에너지 차이가 감소함을 의미한다.
4. 토의 및 고찰
이번 실험은 각 탄소의 p 오비탈이 겹치게 되어 단일결합과 다중결합이 교대로 존재사슬 모양의 π결합을 형성하는 conjugation 현상을 바탕으로 UV-VIS 측정을 통해 전자 전이에 대한 개념과 π-conjugation length 와 흡수 파장과의 관계를 알아보는 실험이었다.
즉, 컨쥬게이션 염료에 UV가 사용되면, 한 분자 궤도함수에서 다른 분자 궤도함수로 전자를 들뜨게 하는데 필요한 양에 해당하는 에너지가 분자에 의해 흡수된다. 이로 인해 전자는 HOMO (highest occupied molecular orbital)에서 LUMO (lowest unoccupied molecular orbital)로 들뜨게 되고, 전자가 결합성 분자 궤도함수로부터 반결합성 분자 궤도함수로 들뜨기 때문에 이것을 들뜸이라고 부른다.
이때 흡수하는 빛의 파장(λ)으로부터 HOMO 와 LUMO 의 에너지 간격을 알 수 있게 된다
ΔE = ELUMO ― EHOMO = hν = hc /λ (h: 플랑크 상수, c: 빛의 속도, λ: 빛의 파장)
또한 컨쥬게이션 분자에서 전이에 영향을 주는데 필요한 정확한 파장은 분자 궤도함수(HOMO 와 LUMO)사이의 에너지 차에 의존하는데, 이것은 슈뢰딩거 방정식(Schrodinger Equation)과 자유 전자 모델을 통해 확인할 수 있다.
1) 슈뢰딩거 방정식(Schrodinger Equation)에서..
n = 1, 2, 3, ... (m:전자의 질량, h: Planck 상수)
2) 자유 전자 모델에서..
/nm = 63.7 (p: 폴리메타인 사슬에 있는 탄소 원자들의 수)
이 때 사슬의 끝에 쉽게 편극이 되는 그룹이 있을 경우(벤젠고리와 같은),
사슬에서 전자들의 퍼텐셜 에너지는 양끝에서 급격히 증가하지 않을 것이고,
이것은 길이 L을 증가시키게 되므로,
/nm=63.7 (a: 주어진 유형에 대한 염료 계열의 상수값. 0
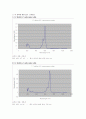
마지막으로 실험에서 가장 중요한 역할을 한 UV-VIS 측정 원리에 대해 살펴보면, 외부에서 적당한 파장의 빛(이 경우 자외선 또는 가시광선 영역)을 분자에 쬐어주면 일정한 전자파 에너지를 흡수하여 들뜬 상태의 높은 에너지 상태로 변하는데 이것을 “분자전이”라하고, 이러한 상호작용 시에는 반사, 산란, 흡수, 형광/인광, 광화학적 반응이 일어나는데, 이 중 흡수 과정만 측정한 UV-VIS 스펙트럼을 이용한 것이 UV-VIS spectroscopy이다.
(흡수: 복사 에너지가 물질에 의해 흡수되어 물질과 에너지 사이에 작용이 일어나는 것.)
또한 전자 전이에 필요한 빛에너지의 크기 및 세기는 분자내의 전자구조, 즉 분자의 화학결합상태나 기하학적 구조 등에 따라 다르게 나타나므로, 분자의 전자 구조적 성질을 규명하는데 매우 유용하다.
5. 참고문헌
물리화학실험, 대한화학회, 청문각, 2007, p118-122
물리화학실험, 이문득, 자유 아카데미, 1997, p189-217
물리화학, 물리화학교재 연구회, 자유 아카데미, 1999, p321-329, p424-427, p609-635
물리화학, 이철현 외 6인, 자유 아카데미, 1999, p560-577, p586-589
http://www.chemexper.com
http://chemistory.tistory.com
http://www.kosha.net/index.jsp (MSDS)
ΔE = ELUMO ― EHOMO = hν = hc /λ (h: 플랑크 상수, c: 빛의 속도, λ: 빛의 파장)
또한 이때 전자는 N/2→n₁(HOMO)에서 N/2+1→n₂(LUMO)로 올라가게 되고,
이로 인한 에너지 변화는 다음과 같다. (N: π전자수)
이 때, 이므로, (c는 빛의 속도)
로 나타낼 수 있고,
여기서 폴리메타인 사슬에 있는 탄소 원자들의 수를 p로 표시하면,
N = p+3 이 되고,
L을 양쪽에 결합길이 1개씩을 더한 질소 원자들 사이에 존재하는 사슬의 길이로 가정하면,
L = (p +3) l 이 되므로, ( l: 사슬을 따라 존재하는 원자들 사이의 결합길이 )
에 대한 식은 다음과 같다.
l=1.39 A=0.139nm로 놓고 (벤젠이나 그와 유사한 결합이 있는 분자의 결합 길이에 해당)
를 나타내면 아래와 같다.
/nm = 63.7
이 때 사슬의 끝에 쉽게 편극이 되는 그룹이 있을 경우(벤젠고리와 같은),
사슬에서 전자들의 퍼텐셜 에너지는 양끝에서 급격히 증가하지 않을 것이고,
이것은 길이 L을 증가시키게 되므로 아래와 같이 나타낼 수 있다.
(a는 주어진 유형에 대한 염료 계열의 상수값. a는 0과 1사이의 값.)
/nm=63.7
이상의 식에서 알 수 있듯이 HOMO 와 LUMO 의 에너지 간격, 즉 에너지의 크기는 빛의 파장인 λ의 크기에 반비례 하고, 빛의 파장 λ의 크기는 폴리메타인 사슬에 있는 탄소 원자들의 수인 p에 비례함을 알 수 있다. 즉, p(폴리메타인 사슬에 있는 탄소 원자들의 수)가 커질수록 빛의 파장인 λ의 값이 커지고, 이러한 λ값의 증가는 에너지 갭의 감소를 유발한다.
여기서 에너지 갭은 HOMO 와 LUMO 사이의 에너지 간격으로 아래 그림과 같다.
====================== ]- 반결합 밴드
====================== LUMO
↑
여기 사이 거리 = 에너지 갭
↓
====================== HOMO ]- 결합 밴드
======================
이러한 결합-반결합 밴드 사이의 거리는 폴리메타인 사슬에 있는 탄소 원자들의 수(p)가 증가 할수록, 즉 π-π 중첩이 더 많이 겹칠수록 (conjugation 정도가 증가할수록) 감소하고, 이것은 conjugation 정도가 높을수록 HOMO 와 LUMO 사이의 에너지 차이가 감소함을 의미한다.
4. 토의 및 고찰
이번 실험은 각 탄소의 p 오비탈이 겹치게 되어 단일결합과 다중결합이 교대로 존재사슬 모양의 π결합을 형성하는 conjugation 현상을 바탕으로 UV-VIS 측정을 통해 전자 전이에 대한 개념과 π-conjugation length 와 흡수 파장과의 관계를 알아보는 실험이었다.
즉, 컨쥬게이션 염료에 UV가 사용되면, 한 분자 궤도함수에서 다른 분자 궤도함수로 전자를 들뜨게 하는데 필요한 양에 해당하는 에너지가 분자에 의해 흡수된다. 이로 인해 전자는 HOMO (highest occupied molecular orbital)에서 LUMO (lowest unoccupied molecular orbital)로 들뜨게 되고, 전자가 결합성 분자 궤도함수로부터 반결합성 분자 궤도함수로 들뜨기 때문에 이것을 들뜸이라고 부른다.
이때 흡수하는 빛의 파장(λ)으로부터 HOMO 와 LUMO 의 에너지 간격을 알 수 있게 된다
ΔE = ELUMO ― EHOMO = hν = hc /λ (h: 플랑크 상수, c: 빛의 속도, λ: 빛의 파장)
또한 컨쥬게이션 분자에서 전이에 영향을 주는데 필요한 정확한 파장은 분자 궤도함수(HOMO 와 LUMO)사이의 에너지 차에 의존하는데, 이것은 슈뢰딩거 방정식(Schrodinger Equation)과 자유 전자 모델을 통해 확인할 수 있다.
1) 슈뢰딩거 방정식(Schrodinger Equation)에서..
n = 1, 2, 3, ... (m:전자의 질량, h: Planck 상수)
2) 자유 전자 모델에서..
/nm = 63.7 (p: 폴리메타인 사슬에 있는 탄소 원자들의 수)
이 때 사슬의 끝에 쉽게 편극이 되는 그룹이 있을 경우(벤젠고리와 같은),
사슬에서 전자들의 퍼텐셜 에너지는 양끝에서 급격히 증가하지 않을 것이고,
이것은 길이 L을 증가시키게 되므로,
/nm=63.7 (a: 주어진 유형에 대한 염료 계열의 상수값. 0
마지막으로 실험에서 가장 중요한 역할을 한 UV-VIS 측정 원리에 대해 살펴보면, 외부에서 적당한 파장의 빛(이 경우 자외선 또는 가시광선 영역)을 분자에 쬐어주면 일정한 전자파 에너지를 흡수하여 들뜬 상태의 높은 에너지 상태로 변하는데 이것을 “분자전이”라하고, 이러한 상호작용 시에는 반사, 산란, 흡수, 형광/인광, 광화학적 반응이 일어나는데, 이 중 흡수 과정만 측정한 UV-VIS 스펙트럼을 이용한 것이 UV-VIS spectroscopy이다.
(흡수: 복사 에너지가 물질에 의해 흡수되어 물질과 에너지 사이에 작용이 일어나는 것.)
또한 전자 전이에 필요한 빛에너지의 크기 및 세기는 분자내의 전자구조, 즉 분자의 화학결합상태나 기하학적 구조 등에 따라 다르게 나타나므로, 분자의 전자 구조적 성질을 규명하는데 매우 유용하다.
5. 참고문헌
물리화학실험, 대한화학회, 청문각, 2007, p118-122
물리화학실험, 이문득, 자유 아카데미, 1997, p189-217
물리화학, 물리화학교재 연구회, 자유 아카데미, 1999, p321-329, p424-427, p609-635
물리화학, 이철현 외 6인, 자유 아카데미, 1999, p560-577, p586-589
http://www.chemexper.com
http://chemistory.tistory.com
http://www.kosha.net/index.jsp (MSDS)


































소개글