본문내용
필요하다.
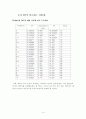
따라서 반응이 1차일 때는 농도와 시간에 대한 함수를 (CA0/CA) vs t 로 변형하여 플롯한 후 직선이 되는지 살펴보고 2차일 때는 농도와 시간에 대한 함수를 1/CA vs t 로 변형하여 플롯한 후 직선이 되는지 살펴 반응 차수를 찾았다.
먼저 55℃에서는 1차로 가정하여 (CA0/CA) vs t 로 변형했을 때보다 2차로 가정하여 1/CA vs t 로 변형시켜 플롯한 결과가 직선과 가까웠다. 이 때의 반응속도상수 K값은 21.397936로 나왔다.
60℃ 에서도 55℃와 마찬가지로 (CA0/CA) vs t 로 변형했을 때보다 1/CA vs t 로 변형하여 플롯했을 때가 직선에 가깝게 나왔으며 이 때의 반응속도 상수 K는 18.514828이 나왔다.
70℃ 에서는 60℃, 55℃와는 달리 직선에 거의 일치하지 않게 나왔다. 이때의 반응속도 상수 K는 20.322870가 나왔다.
데이터를 보면 이론적인 결과와는 달리 55℃에서의 반응속도 상수가 가장 크게 나왔다. 이 것은 실험을 하면서 오차가 발생했다고 생각할 수도 있지만 다르게 해석하면 반응 적정온도가 55℃에 가까웠다고 할 수 있다. 그 이유는 절대적으로 K값은 온도에 비례하지만 실험적으로 변수를 온도에 놓고 실험을 했을 시에 겉보기 반응은 그 반응물의 물성에 따라 그 반대일 수도 있다는 것이다.
에틸아세테이트의 B.P는 75℃정도 된다. 이 때 에틸아세테이트의 분자는 기화되기전의 운동이 최고조에 달하게 되는데 교반이 잘 안되었을 때 전해질에 의한 전도도 측정이 저해를 받을 수 있다.
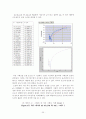
화학반응 실험이 진행되는 동안 전도도에 영향을 주는 이온은 Na+, OH-, CH3COO-, 이며 반응중 Na+이온의 농도는 일정하지만 OH- 이온은 반응 중에 점차로 감소하게 되어 사라지게 되며 CH3COO-이온이 생성되어 전도도 값에 영향을 주게 된다. 이 때문에 70℃에서의 1차와 2차 반응의 그래프가 일정한 값이 아닌 불규칙적인 농도분포를 나타낸 것이다.
다르게 해석하면 온도에 의해 가역반응에 영향을 주어 역반응 속도가 정반응 속도보다 커졌기 때문에 CA VS T 그래프에서 점점 감소하다가 다시 농도가 증가 했다 감소하는 봉우리 형태가 나타났을 가능성도 있다.
이번 실험은 하는데 많은 어려움이 있었다. 특히 가장 중요한 등온공정을 만들지 못한 점에서 큰 오차가 발생했다고 볼 수 있다. 부가적인 오차의 원인으로 반응차수는 농도에도 영향을 받는데 반응물의 농도가 낮았기 때문에 저장탱크나 이동호스, 반응기내부에 약간씩 들어있던 물이 농도를 묽게 만들었을 가능성이 있다.
이러한 오차를 개선하기 위해서는 반응이 일어날 때 반응용액에 에탄올을 매우 소량 넣어주어서 반응이 잘 일어나게 해주고, 반응기내의 물이 되도록 많이 제거되도록 밸브를 오랫동안 열어두고 깨끗이 세척한 후에 실험을 해야 한다. 하지만 그러지 못한 점이 오차를 더욱 크게 만들었던 요인이 되었을 것으로 생각된다.
4. CONCLUSION
회분 반응기는 균일반응에 대한 속도식 파라미터인 반응차수와 반응속도상수를 구하는데 많이 이용이 된다. 우리의 목적은 에틸아세테이트와 수산화나트륨과의 반응을 전도도를 통해 시간과 농도에 대해 측정한후 자료 해석의 미분법 또는 적분법중의 어느 하나를 이용하여 반응차수 a와 반응속도 상수 k를 구하는 것이다. 반응속도는 반응 속도 상수와 함께 농도에 비례한다. 이때의 방법은 과량법으로 낮은 농도의 반응물을 한계반응물로 정하고 다른 반응물은 과량으로 집어넣어 상수로 반들고 이 때의 데이터를 이용하여 적분법 혹은 미분법을 이용하여 반응속도 상수와 반응차수를 결정하는 것이다.
우선 미분법을 통해 반응차수와 반응속도상수를 결정한 결과 55℃는 ln(-dCA/dt) Vs ln CA 그래프 회귀식에서 반응 차수 a가 2.325983이 나왔고 반응속도상수인 K가 4.484005이 나왔다.
60℃는 반응 차수 a가 2.241072, 반응속도상수 K가 4.228949이 나왔고 70℃에서는 반응차수 a가 2.529485, 반응속도상수인 K가 5.720657이 나왔다.
적분법에 의한 방법으는 먼저 55℃에서는 1차로 가정하여 (CA0/CA) vs t 로 변형했을 때보다 2차로 가정하여 1/CA vs t 로 변형시켜 플롯한 결과가 직선과 가까웠다. 이 때의 반응속도상수 K값은 21.397936로 나왔다.
60℃ 에서도 55℃와 마찬가지로 (CA0/CA) vs t 로 변형했을 때보다 1/CA vs t 로 변형하여 플롯했을 때가 직선에 가깝게 나왔으며 이 때의 반응속도 상수 K는 18.514828이 나왔다.
70℃ 에서는 60℃, 55℃와는 달리 직선에 거의 일치하지 않게 나왔다. 이때의 반응속도 상수 K는 20.322870가 나왔다.
전체적인 데이터를 보면 이론적인 결과와는 달리 55℃에서의 반응속도 상수가 가장 크게 나왔다. 이 것은 실험을 하면서 오차가 발생했다고 생각할 수도 있지만 다르게 해석하면 반응 적정온도가 55℃에 가까웠다고 할 수 있다. 그 이유는 에틸아세테이트의 B.P는 때문이다. 에틸아세테이트의 B.P는 70℃에서 가깝고, 이 때 에틸아세테이트의 분자는 기화되기전의 운동이 최고조에 달하게 되는데 교반이 잘 안되었을 때 전해질에 의한 전도도 측정이 저해를 받을 수 있다.
다르게 해석하면 온도에 의해 가역반응에 영향을 주어 역반응 속도가 정반응 속도보다 커졌기 때문에 CA VS T 그래프에서 점점 감소하다가 다시 농도가 증가 했다 감소하는 봉우리 형태가 나타났을 가능성도 있다.
현재 반응 공학을 배우고 있는 공학도로써 반응기 설계에 있어 중요한 반응속도결정 실험을 할 수 있는 좋은 기회였지만 온도제어가 안되는 하드웨어 문제 때문에 오차가 많이 발생했다. 다음 기회가 주어진다면 제대로 실험을 해보고 싶다.
5. REFERENCE
1. 화학반응공학/ Octave Levenspiel, 2000/ (주)사이텍 미디어/ p.320~335
2. 반응 공학/ 장현태외 3인 공역/ 동화기술/ p.108~120
3. 반응공학/ 대영사/ 설수덕/ p.239~248
4. 화학반응공학/ 마크 E. 데이비스, 홍연기/ 동화기술/ P.112~130
따라서 반응이 1차일 때는 농도와 시간에 대한 함수를 (CA0/CA) vs t 로 변형하여 플롯한 후 직선이 되는지 살펴보고 2차일 때는 농도와 시간에 대한 함수를 1/CA vs t 로 변형하여 플롯한 후 직선이 되는지 살펴 반응 차수를 찾았다.
먼저 55℃에서는 1차로 가정하여 (CA0/CA) vs t 로 변형했을 때보다 2차로 가정하여 1/CA vs t 로 변형시켜 플롯한 결과가 직선과 가까웠다. 이 때의 반응속도상수 K값은 21.397936로 나왔다.
60℃ 에서도 55℃와 마찬가지로 (CA0/CA) vs t 로 변형했을 때보다 1/CA vs t 로 변형하여 플롯했을 때가 직선에 가깝게 나왔으며 이 때의 반응속도 상수 K는 18.514828이 나왔다.
70℃ 에서는 60℃, 55℃와는 달리 직선에 거의 일치하지 않게 나왔다. 이때의 반응속도 상수 K는 20.322870가 나왔다.
데이터를 보면 이론적인 결과와는 달리 55℃에서의 반응속도 상수가 가장 크게 나왔다. 이 것은 실험을 하면서 오차가 발생했다고 생각할 수도 있지만 다르게 해석하면 반응 적정온도가 55℃에 가까웠다고 할 수 있다. 그 이유는 절대적으로 K값은 온도에 비례하지만 실험적으로 변수를 온도에 놓고 실험을 했을 시에 겉보기 반응은 그 반응물의 물성에 따라 그 반대일 수도 있다는 것이다.
에틸아세테이트의 B.P는 75℃정도 된다. 이 때 에틸아세테이트의 분자는 기화되기전의 운동이 최고조에 달하게 되는데 교반이 잘 안되었을 때 전해질에 의한 전도도 측정이 저해를 받을 수 있다.
화학반응 실험이 진행되는 동안 전도도에 영향을 주는 이온은 Na+, OH-, CH3COO-, 이며 반응중 Na+이온의 농도는 일정하지만 OH- 이온은 반응 중에 점차로 감소하게 되어 사라지게 되며 CH3COO-이온이 생성되어 전도도 값에 영향을 주게 된다. 이 때문에 70℃에서의 1차와 2차 반응의 그래프가 일정한 값이 아닌 불규칙적인 농도분포를 나타낸 것이다.
다르게 해석하면 온도에 의해 가역반응에 영향을 주어 역반응 속도가 정반응 속도보다 커졌기 때문에 CA VS T 그래프에서 점점 감소하다가 다시 농도가 증가 했다 감소하는 봉우리 형태가 나타났을 가능성도 있다.
이번 실험은 하는데 많은 어려움이 있었다. 특히 가장 중요한 등온공정을 만들지 못한 점에서 큰 오차가 발생했다고 볼 수 있다. 부가적인 오차의 원인으로 반응차수는 농도에도 영향을 받는데 반응물의 농도가 낮았기 때문에 저장탱크나 이동호스, 반응기내부에 약간씩 들어있던 물이 농도를 묽게 만들었을 가능성이 있다.
이러한 오차를 개선하기 위해서는 반응이 일어날 때 반응용액에 에탄올을 매우 소량 넣어주어서 반응이 잘 일어나게 해주고, 반응기내의 물이 되도록 많이 제거되도록 밸브를 오랫동안 열어두고 깨끗이 세척한 후에 실험을 해야 한다. 하지만 그러지 못한 점이 오차를 더욱 크게 만들었던 요인이 되었을 것으로 생각된다.
4. CONCLUSION
회분 반응기는 균일반응에 대한 속도식 파라미터인 반응차수와 반응속도상수를 구하는데 많이 이용이 된다. 우리의 목적은 에틸아세테이트와 수산화나트륨과의 반응을 전도도를 통해 시간과 농도에 대해 측정한후 자료 해석의 미분법 또는 적분법중의 어느 하나를 이용하여 반응차수 a와 반응속도 상수 k를 구하는 것이다. 반응속도는 반응 속도 상수와 함께 농도에 비례한다. 이때의 방법은 과량법으로 낮은 농도의 반응물을 한계반응물로 정하고 다른 반응물은 과량으로 집어넣어 상수로 반들고 이 때의 데이터를 이용하여 적분법 혹은 미분법을 이용하여 반응속도 상수와 반응차수를 결정하는 것이다.
우선 미분법을 통해 반응차수와 반응속도상수를 결정한 결과 55℃는 ln(-dCA/dt) Vs ln CA 그래프 회귀식에서 반응 차수 a가 2.325983이 나왔고 반응속도상수인 K가 4.484005이 나왔다.
60℃는 반응 차수 a가 2.241072, 반응속도상수 K가 4.228949이 나왔고 70℃에서는 반응차수 a가 2.529485, 반응속도상수인 K가 5.720657이 나왔다.
적분법에 의한 방법으는 먼저 55℃에서는 1차로 가정하여 (CA0/CA) vs t 로 변형했을 때보다 2차로 가정하여 1/CA vs t 로 변형시켜 플롯한 결과가 직선과 가까웠다. 이 때의 반응속도상수 K값은 21.397936로 나왔다.
60℃ 에서도 55℃와 마찬가지로 (CA0/CA) vs t 로 변형했을 때보다 1/CA vs t 로 변형하여 플롯했을 때가 직선에 가깝게 나왔으며 이 때의 반응속도 상수 K는 18.514828이 나왔다.
70℃ 에서는 60℃, 55℃와는 달리 직선에 거의 일치하지 않게 나왔다. 이때의 반응속도 상수 K는 20.322870가 나왔다.
전체적인 데이터를 보면 이론적인 결과와는 달리 55℃에서의 반응속도 상수가 가장 크게 나왔다. 이 것은 실험을 하면서 오차가 발생했다고 생각할 수도 있지만 다르게 해석하면 반응 적정온도가 55℃에 가까웠다고 할 수 있다. 그 이유는 에틸아세테이트의 B.P는 때문이다. 에틸아세테이트의 B.P는 70℃에서 가깝고, 이 때 에틸아세테이트의 분자는 기화되기전의 운동이 최고조에 달하게 되는데 교반이 잘 안되었을 때 전해질에 의한 전도도 측정이 저해를 받을 수 있다.
다르게 해석하면 온도에 의해 가역반응에 영향을 주어 역반응 속도가 정반응 속도보다 커졌기 때문에 CA VS T 그래프에서 점점 감소하다가 다시 농도가 증가 했다 감소하는 봉우리 형태가 나타났을 가능성도 있다.
현재 반응 공학을 배우고 있는 공학도로써 반응기 설계에 있어 중요한 반응속도결정 실험을 할 수 있는 좋은 기회였지만 온도제어가 안되는 하드웨어 문제 때문에 오차가 많이 발생했다. 다음 기회가 주어진다면 제대로 실험을 해보고 싶다.
5. REFERENCE
1. 화학반응공학/ Octave Levenspiel, 2000/ (주)사이텍 미디어/ p.320~335
2. 반응 공학/ 장현태외 3인 공역/ 동화기술/ p.108~120
3. 반응공학/ 대영사/ 설수덕/ p.239~248
4. 화학반응공학/ 마크 E. 데이비스, 홍연기/ 동화기술/ P.112~130