목차
목차없음
본문내용
n의 위, 아래에서의 평형단은 수직선(yn, xn+1)에서 (yn+1, xn+1)까지에서, 수평선은 (yn-1, xn)에서 (yn-1, xn-1)까지 위치한다. 계단적 구조는 대각선과 정류선의 교점에서 시작하여 보일러의 농도가 xb일때 까지 계속된다. 필요한 판의 수는 평형곡선과 조작선의 사이에 그려진 수평선들의 수에 의해 알 수 있다.
실험기구 및 시료
다단증류장치 , 매스실린더 100ml 1개, 삼각 플라스크 100㎖ 6개 , 비중병(굴절계) 8개 메타올 20L, 증류수 10L, 초시계, 공학용계산기, 20cm자
실험 방법
먼저 시험에 사용할 50mol%메탄올 용액20L, 10mol% 메탄올 용액 4L를 제조하였다. 다단증류장치의 모든 벨브와 스위치를 off상태를 확인한 후
다단증류기가 정상적으로 작동하는 지를 점거하였고, 증류기의 각 전원과 센서들이 정상적으로 작동되는 지를 확인 하였다. 50mol%, 10mol%용액을
각각 공급액 탱크와 재비기탱크에 넣고 응축기에 냉각수를 흘려보내 주었다.
다음 재배기를 1.8KW로 가열하여 메탄올용액을 서서히 가열하여 메탄올 용액이 증류탑에서 단계적으로 증류가 일어나는 것을 확인 할수있었다.
탑 맨 상부에서 냉각장치로부터 응축되어 응축액 받이에 모이게 되는데
30분 단위로 응축액의 유량을 매스 실린더를 이용하여 측정하여주고 25m비중병에탑상저장탱크와 탑하제품저장탱크의 응축액을 동시간에 비중병에 담아주었다. 30분간격으로 4번 2시간동안 샘플링과 유출액의 유량을 측정을 하여주었다. 이렇게 2시간이 지난뒤 샘플링과 유챌액 유량측정이끝나고나서 장치의 가동을 멈추어주고 장치내부에잇는 용액을 빼내준뒤 세척을 실시하고 샘플링을 하여놓은 비중병은 질량을 측정하여주었다.
샘플링을 해준 용액의 기준자료를 위하여 메탄올 mol%로 0%, 20%, 40%, 60%, 80%, 100%의 비중병내의 용액 무게를 측정하여 표로 만들어주었다
RESULT
RAW DATA
에탄올-물 표준용액 용액의 무게와 에탄올 질량분율그래프
EtOH(wt%)
용액무게
0
24.90
20
24.09
40
23.28
60
22.11
80
20.96
100
19.60
y = -18.691x + 470.32 위의 식에서
표준용액으로 표준용액 곡선의 방정식을 구한다. 여기서 y는 메탄올의 wt%이고,
x는 비중병의 무게를 뺀 용액의 무게이다. 이 표준곡선을 이용해 탑의 상부와 하부에서
받은 생성물의 농도를 계산한다.
시간에 따른 변화량
시간
1hr
2hr
3hr
공급액
온도(℃)
79
80
80
유량(ml/min)
34.7
35.1
35.2
무게
21.31
21.32
21.31
mol%
50.17
49.94
50.17
탑상부
온도(℃)
80
81
81
탑상부 응축액
유량(ml/min)
14.10
14.20
14.20
탑상부 생성물
무게
20.47
20.45
20.46
mol%
73.6
74.3
74
환류액
유량(ml/min)
7.14
7.23
7.23
재비기
온도(℃)
89
89
89
탑하부 생성물
무게
24.15
24.21
24.23
mol%
8.37
7.82
7.63
최소이론단수, 최적도입단구하기
환류비 RD 값은 1로 가정하였다.
정류부 조작선의 Y절편
탑상부 생성물 농도 ( ) : 0.742
탑하부 생성물 농도 ( ) : 0.0723
방법
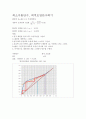
1.먼저 에탄올 물의 액기 조성곡선을 그린다
2.y절편을 계산하고 그린다.
3.상부,하부,공급액의 조성에 맞춰 y=x까지 그린다.
4.공급액 조성 선에서 q값은 포화액이기 때문에 1로 가정하고 위로 그린다.
5.q값을 그린지점과 하부액 조성이 만나게 서로 이은다.
6. 마지막으로 계단처럼 선을 그리면서 단수를 구한다.
이론단수 최적 도입단
6단 4단
효율 7단/8단 X 100 = 87.5%
최적도입단과 이론단수를 구한 그림.
DISCUSSION
이번 실험은 다단식 연속 증류장치(증류탑)을 사용하여 이성분용액의 분리와 정류의 기본원리를 습득하고 McCabe-Thiele Method를 이용한 이론단수 및 단 효율을 계산하며 정류공정의 이해 및 운전방법을 습득해 보았다
실험은 50wt% EtOH 20ℓ를 공급탱크에, 재비기에 10wt% EtOH 4ℓ의 넣는 것으로 시작하였다. 환류펌프의 전 조의 실험을 통해서 0.8로 맞추어진 상태여서 따로 조작하지는 않았다. 실험의 결과 에탄올의 wt%를 구할 수 있었다. 실험전의 표준용액에 대한 wt%를 가지고 표준용액의 그래프를 plot하여 실험의 결과로 나온 값을 대입하여 구할 수 있는데, 탑 상부 생성물 농도는 0.742이 탑 하부 생성물 농도는 0.0723이 나왔다. 이 값들을 통하여서 격자위에 위와 같은 그래프를 얻을 수 있었는데, 그래프 안에서 격자사이의 거리를 재서 단의 개수를 구하는 구할 수 있었다. 그래프에 직각의 선을 연결하여 단을 구한 결과 이론 단수가 ‘7’이 나왔다. 실험의 결과를 통해서 얻은 이론단수 ‘7’을 통해서 효율을 구한 결과는 87.5%가 나왔으며 최적도입단은 4단이 나왔다. 오차가 발생한 원인으로는 일단 표준용액 계산 시 4도씨 물의 밀도인 1g/cm3을 가정해 일단 표준용액의 그래프에서 오차가 나왔을 것이며 또한 RD값을 포화액이라 가정하여 놓고 계산하였다. 만약 포화액이 아니라면 1이 아닐 것이며 이는 y절편의 변화로 이어지므로 단수에 변화가 생길 수 있으며 에탄올과 물의 액 기 조성 곡선이 문헌 값을 참고한 것이기 때문에 실험상황과 달라 오차가 생긴 것일 수 있고 이러한 오차를 줄이기 위해서는 효율적인 방법으로 물과 에탄올은 공비점이 생기는 물질이기 때문에 제3의 물질 이와 같은 상황에서는 벤젠을 첨가한다면 더욱 상단부에서 추출되는 에탄올의 조성이 높아졌을 것이며 농도가 더욱 높아졌다면 우리가 구한 단수가 이론단수가 실제단수와 일치 할수 있었을 것이다.
Reference
화학공학실험 강의자료 실험교재 전북대학교 화학공학부
중소형 화학공장을 위한 다단 증류분리장치의 통합설계 Package 개발 연구
물리화학,청문각,THOMAS ENGEL, Philip Reid 저
화학공학유체역학 마이크로유체학과 CFD 도서출판 한산 james o.wilkes
실험기구 및 시료
다단증류장치 , 매스실린더 100ml 1개, 삼각 플라스크 100㎖ 6개 , 비중병(굴절계) 8개 메타올 20L, 증류수 10L, 초시계, 공학용계산기, 20cm자
실험 방법
먼저 시험에 사용할 50mol%메탄올 용액20L, 10mol% 메탄올 용액 4L를 제조하였다. 다단증류장치의 모든 벨브와 스위치를 off상태를 확인한 후
다단증류기가 정상적으로 작동하는 지를 점거하였고, 증류기의 각 전원과 센서들이 정상적으로 작동되는 지를 확인 하였다. 50mol%, 10mol%용액을
각각 공급액 탱크와 재비기탱크에 넣고 응축기에 냉각수를 흘려보내 주었다.
다음 재배기를 1.8KW로 가열하여 메탄올용액을 서서히 가열하여 메탄올 용액이 증류탑에서 단계적으로 증류가 일어나는 것을 확인 할수있었다.
탑 맨 상부에서 냉각장치로부터 응축되어 응축액 받이에 모이게 되는데
30분 단위로 응축액의 유량을 매스 실린더를 이용하여 측정하여주고 25m비중병에탑상저장탱크와 탑하제품저장탱크의 응축액을 동시간에 비중병에 담아주었다. 30분간격으로 4번 2시간동안 샘플링과 유출액의 유량을 측정을 하여주었다. 이렇게 2시간이 지난뒤 샘플링과 유챌액 유량측정이끝나고나서 장치의 가동을 멈추어주고 장치내부에잇는 용액을 빼내준뒤 세척을 실시하고 샘플링을 하여놓은 비중병은 질량을 측정하여주었다.
샘플링을 해준 용액의 기준자료를 위하여 메탄올 mol%로 0%, 20%, 40%, 60%, 80%, 100%의 비중병내의 용액 무게를 측정하여 표로 만들어주었다
RESULT
RAW DATA
에탄올-물 표준용액 용액의 무게와 에탄올 질량분율그래프
EtOH(wt%)
용액무게
0
24.90
20
24.09
40
23.28
60
22.11
80
20.96
100
19.60
y = -18.691x + 470.32 위의 식에서
표준용액으로 표준용액 곡선의 방정식을 구한다. 여기서 y는 메탄올의 wt%이고,
x는 비중병의 무게를 뺀 용액의 무게이다. 이 표준곡선을 이용해 탑의 상부와 하부에서
받은 생성물의 농도를 계산한다.
시간에 따른 변화량
시간
1hr
2hr
3hr
공급액
온도(℃)
79
80
80
유량(ml/min)
34.7
35.1
35.2
무게
21.31
21.32
21.31
mol%
50.17
49.94
50.17
탑상부
온도(℃)
80
81
81
탑상부 응축액
유량(ml/min)
14.10
14.20
14.20
탑상부 생성물
무게
20.47
20.45
20.46
mol%
73.6
74.3
74
환류액
유량(ml/min)
7.14
7.23
7.23
재비기
온도(℃)
89
89
89
탑하부 생성물
무게
24.15
24.21
24.23
mol%
8.37
7.82
7.63
최소이론단수, 최적도입단구하기
환류비 RD 값은 1로 가정하였다.
정류부 조작선의 Y절편
탑상부 생성물 농도 ( ) : 0.742
탑하부 생성물 농도 ( ) : 0.0723
방법
1.먼저 에탄올 물의 액기 조성곡선을 그린다
2.y절편을 계산하고 그린다.
3.상부,하부,공급액의 조성에 맞춰 y=x까지 그린다.
4.공급액 조성 선에서 q값은 포화액이기 때문에 1로 가정하고 위로 그린다.
5.q값을 그린지점과 하부액 조성이 만나게 서로 이은다.
6. 마지막으로 계단처럼 선을 그리면서 단수를 구한다.
이론단수 최적 도입단
6단 4단
효율 7단/8단 X 100 = 87.5%
최적도입단과 이론단수를 구한 그림.
DISCUSSION
이번 실험은 다단식 연속 증류장치(증류탑)을 사용하여 이성분용액의 분리와 정류의 기본원리를 습득하고 McCabe-Thiele Method를 이용한 이론단수 및 단 효율을 계산하며 정류공정의 이해 및 운전방법을 습득해 보았다
실험은 50wt% EtOH 20ℓ를 공급탱크에, 재비기에 10wt% EtOH 4ℓ의 넣는 것으로 시작하였다. 환류펌프의 전 조의 실험을 통해서 0.8로 맞추어진 상태여서 따로 조작하지는 않았다. 실험의 결과 에탄올의 wt%를 구할 수 있었다. 실험전의 표준용액에 대한 wt%를 가지고 표준용액의 그래프를 plot하여 실험의 결과로 나온 값을 대입하여 구할 수 있는데, 탑 상부 생성물 농도는 0.742이 탑 하부 생성물 농도는 0.0723이 나왔다. 이 값들을 통하여서 격자위에 위와 같은 그래프를 얻을 수 있었는데, 그래프 안에서 격자사이의 거리를 재서 단의 개수를 구하는 구할 수 있었다. 그래프에 직각의 선을 연결하여 단을 구한 결과 이론 단수가 ‘7’이 나왔다. 실험의 결과를 통해서 얻은 이론단수 ‘7’을 통해서 효율을 구한 결과는 87.5%가 나왔으며 최적도입단은 4단이 나왔다. 오차가 발생한 원인으로는 일단 표준용액 계산 시 4도씨 물의 밀도인 1g/cm3을 가정해 일단 표준용액의 그래프에서 오차가 나왔을 것이며 또한 RD값을 포화액이라 가정하여 놓고 계산하였다. 만약 포화액이 아니라면 1이 아닐 것이며 이는 y절편의 변화로 이어지므로 단수에 변화가 생길 수 있으며 에탄올과 물의 액 기 조성 곡선이 문헌 값을 참고한 것이기 때문에 실험상황과 달라 오차가 생긴 것일 수 있고 이러한 오차를 줄이기 위해서는 효율적인 방법으로 물과 에탄올은 공비점이 생기는 물질이기 때문에 제3의 물질 이와 같은 상황에서는 벤젠을 첨가한다면 더욱 상단부에서 추출되는 에탄올의 조성이 높아졌을 것이며 농도가 더욱 높아졌다면 우리가 구한 단수가 이론단수가 실제단수와 일치 할수 있었을 것이다.
Reference
화학공학실험 강의자료 실험교재 전북대학교 화학공학부
중소형 화학공장을 위한 다단 증류분리장치의 통합설계 Package 개발 연구
물리화학,청문각,THOMAS ENGEL, Philip Reid 저
화학공학유체역학 마이크로유체학과 CFD 도서출판 한산 james o.wilkes
추천자료
 [화학공학/재료공학]전기전도도와 열전도도의 관한 termpaper 자료
[화학공학/재료공학]전기전도도와 열전도도의 관한 termpaper 자료 기초공학실험 - 온도측정
기초공학실험 - 온도측정 열유체공학실험 물 대류 열전달
열유체공학실험 물 대류 열전달  열유체공학실험 공기 물 대류 열전달
열유체공학실험 공기 물 대류 열전달 7. 전기공학실험 중첩의 원리
7. 전기공학실험 중첩의 원리 [화학공학] 열풍 온도 제어 시스템
[화학공학] 열풍 온도 제어 시스템 [화학공학] 화학적 산소 요구량[COD]
[화학공학] 화학적 산소 요구량[COD] [화학공학]칼슘정량
[화학공학]칼슘정량 [화학공학] 완충용액 - 산, 염기 반응의 ph적정원리, 완충용약을 사용하는 목적
[화학공학] 완충용액 - 산, 염기 반응의 ph적정원리, 완충용약을 사용하는 목적 [재료공학실험보고서a+자료] 열처리 실험
[재료공학실험보고서a+자료] 열처리 실험 [화학공학] 혼합조 - 유입속도, 탱크용량, 초기농도에 따른 응답특성의 변화를 측정
[화학공학] 혼합조 - 유입속도, 탱크용량, 초기농도에 따른 응답특성의 변화를 측정 공학실험 - 동점성계수 측정 실험
공학실험 - 동점성계수 측정 실험 [기계공학실험 A] 크리프 실험
[기계공학실험 A] 크리프 실험 11. 전기전도도,화학공학부(
11. 전기전도도,화학공학부(































소개글