본문내용
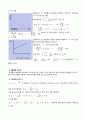
3) 적분법을 이용하여 반응차수 예상하기
(1) vs plot ( 0차 반응 가정 )
(기울기 k = 0.00005)
여기서 k는 반응속도 상수
(2) vs plot ( 1차 반응 가정 )
( 기울기 k = 0 )
여기서 k는 반응속도 상수
(3) vs t plot ( 2차 반응 가정 )
( 기울기 k = -70.469 )
여기서 k는 반응속도 상수
4) R값 비교
plot
반응
R값
Ca vs
0차반응
0.5645
vs
1차반응
0
vs t
2차반응
0.638
R값이 가장 큰 경우가 가장 선형이라는 의미이며 가장 큰 경우가 vs t plot한 2차 반응이므로
이번 실험의 반응은 2차반응 이라고 할 수 있다. (농도가 (-)라 큰 의미는 없지만 나온 그래프를 토대로 분석해 보았다.)
5) 실험사진
교반 항온조에서 초산에틸과 혼합물 20ml씩 넣는 사진 factor값을 위해 적정하는 사진
NaOH 섞는 사진
→
HCl 표준용액에 반응혼합물을 넣고 페놀프탈레인 지시약을 넣고 NaOH 표준용액으로 역적정한 사진
7.실험 고찰
이번 실험은 초산에틸의 검화를 통해 최종적으로 이의 차수가 몇 차인지 구하는 것이었다. 본격적인 실험에 앞서 표준용액의 농도를 정확히 하기 위해서 0.05N의 HCl 20ml 적정하는데 0.05N NaOH가 26mL 소모되었음을 이용하여 factor 값을 구해 조제한 표준용액의 농도를 보정을 해 주었다. 그리고 초산에틸과 NaOH의 반응에서 생성된 물질의 농도를 측정하기 위해서 HCl을 첨가해 반응했던 NaOH보다 더 높은 농도의 NaOH 표준용액으로 역적정 하는 방법을 사용하였다. 역적정은 이번 실험에서와 같이 농도를 모르는 NaOH 용액을 농도를 아는 염산 과량에 넣은 후, 농도를 아는 NaOH 용액으로 적정을 하여 중화점을 찾아 농도를 모르는 NaOH 용액의 농도를 찾는 방법이다. 역적정을 이용해 역적정한 NaOH양을 찾고 농도를 구해본 결과 많은 오차가 발생하였다. 일단 기본적으로 농도가 음수(-)값을 가질 수 없는데 음수(-)값이 나왔다. 농도가 음수(-)값이 나온 것이 이번 실험 data에 가장 큰 영향을 미쳤는데 그 원인을 생각해보면, 첫 번째 원인은 역적정할 때 정확하게 페놀프탈레인 시약 변색때를 기준으로 역적정하지 못하고 NaOH 용액을 더 넣은 것이다. NaOH 용액을 더 넣어주게 되면 당연히 (20-보정한 NaOH양)값에서 음수(-)값이 나올 수 밖에 없다. 두 번째 원인은 역적정하기전 0.02N초산에틸과 NaOH가 반응할 때 반응이 제대로 이루어지지 않았을 것으로 생각된다. 그 이유는 초산에틸은 에스테르이기 때문에(카복실산 유도체중에 반응성이 낮은편에 속함) NaOH와의 반응이 빠르지 않다. 그러므로 반응시켜준 시간을 길게 하면 길게 할수록 반응은 더 많이 일어날 것이다. 세 번째 원인은 factor값을 구할 때 적정이 정확하게 이루어지지 않았다는 것이다. 이번 실험을 기준으로 농도가 양수(+)값이 나오게 되려면 factor값이 좀더 작게 나왔어야 했다. 그 외 다른원인은 반응이 플라스크의 가장자리부터 시작되기 때문에 최대한 가장자리 쪽의 용액을 취해야했는데 그러지 않았고 도중에 역반응이 일어났을 수도 있다고 생각한다. 일단 음수(-)값의 농도 data로 계산해 반응속도 식을 결정해보았다. 반응속도 식을 결정하는 방법은 시간에 따른 온도변화 data를 이용하는 미분법과 시간에 따른 농도의 변화 data를 이용하는 적분법이 있다. 본 실험에서는 적분법을 사용해서 반응속도 식을 결정하였다. 적분법을 이용할 때, 시간과 농도이외의 요인은 일정하게 유지해주어야 한다. 본 실험의 변수는 온도, 농도, 시간이고, 농도와 시간을 이외의 요인인 온도를 일정하게 유지하는 것이 중요하다. 따라서 항온수조를 사용하여 일정한 온도를 유지해주었다.
애초에 실험 data값이 측정불가능한 값이 나와서 각 반응차수마다 plot한 것이 정확하게 맞아떨어지지는 않지만 plot한 것을 해석해보면, 0차반응이라 예상한 경우 에서 보정한NaOH양이 점점 시간이 갈수록 줄어들기 때문에 농도가 떨어지는 그래프가 나와야 하지만 (-)부호의 농도 때문에 반대로 농도가 증가하는 그래프가 나왔다. 1차반응이라 예상한 경우 수학적으로 ln은 (/)값이 양수(+)값이 나와야 계산이 가능한데, 음수(-)값이 나와 계산이 불가능해 없는 그래프로 생각했다. 2차반응이라 예상한 경우 농도의 역수값으로 0차반응이라 예상한 경우와 반대로 (-)기울기가 나와야했지만 (-)값의 농도로 인해 (+)값의 기울기를 가진 그래프가 나왔다. 이번 실험에서는 결과값이 예상범주와 다르게 나왔지만, 실제 이상적으로 실험을 하여 농도값이 (+)값이 나온경우를 생각해보면 2차반응 그래프에서 (+)기울기 값을 가진 대체로 R값이 0.9 이상인 선형식이 나왔을 것으로 예상할 수 있다. 좀더 확실한 data값을 구하기 위해서는 첫 번째, 적정을 얼마나 정확하게 하는가에 달려있다. 그 이유는 factor값을 구할 때 그리고 역적정할 때 두곳에서 적정이 이루어지기 때문이다. 중화적정이 이루어지는 구간을 좀더 신중하게 한방울씩 적가 했으면 더 좋았겠고, 지시약을 페놀프탈레인용액 대신 BTB용액이나 다른 지시약을 이용해 정확하게 중화점을 찾는 것도 좋은 방법이 될 것이다. 두 번째, 반응시간 간격을 충분한 시간을 두고 실험을 해야한다. 초산에틸과 수산화나트륨 용액의 반응이 느리게 일어나는편이라 충분한 시간하에 반응을 다 일으켰으면 더 정확한 실험 data값을 얻었을 것이다. 세 번째, 온도의 영향도 무시할 수 없기 때문에 항온조의 온도변화가 일어났는지 확인해야한다. 네 번째, 용액을 측정하는 기구를 통일하는 것이 좋다. 비커의 눈금, 메스실린더의 눈금, 피펫의 눈금 모두 정확성이 다 다르기 때문에 측정도구를 통일해 측정오차를 줄이면 보다 정확한 data값을 얻을 수 있다고 생각한다.
8. 사용 기호
기호
단위
기호
단위
t
CH2COOC2H5의 반응 시간(min)
K,n
초기농도[mol/L]
역적정한 NaOH의 양[N]
초기 농도[N]
반응 속도 상수(1/t)
V
반응속도[농도변화량/시간변화량]
9. 참고문헌
(1) vs plot ( 0차 반응 가정 )
(기울기 k = 0.00005)
여기서 k는 반응속도 상수
(2) vs plot ( 1차 반응 가정 )
( 기울기 k = 0 )
여기서 k는 반응속도 상수
(3) vs t plot ( 2차 반응 가정 )
( 기울기 k = -70.469 )
여기서 k는 반응속도 상수
4) R값 비교
plot
반응
R값
Ca vs
0차반응
0.5645
vs
1차반응
0
vs t
2차반응
0.638
R값이 가장 큰 경우가 가장 선형이라는 의미이며 가장 큰 경우가 vs t plot한 2차 반응이므로
이번 실험의 반응은 2차반응 이라고 할 수 있다. (농도가 (-)라 큰 의미는 없지만 나온 그래프를 토대로 분석해 보았다.)
5) 실험사진
교반 항온조에서 초산에틸과 혼합물 20ml씩 넣는 사진 factor값을 위해 적정하는 사진
NaOH 섞는 사진
→
HCl 표준용액에 반응혼합물을 넣고 페놀프탈레인 지시약을 넣고 NaOH 표준용액으로 역적정한 사진
7.실험 고찰
이번 실험은 초산에틸의 검화를 통해 최종적으로 이의 차수가 몇 차인지 구하는 것이었다. 본격적인 실험에 앞서 표준용액의 농도를 정확히 하기 위해서 0.05N의 HCl 20ml 적정하는데 0.05N NaOH가 26mL 소모되었음을 이용하여 factor 값을 구해 조제한 표준용액의 농도를 보정을 해 주었다. 그리고 초산에틸과 NaOH의 반응에서 생성된 물질의 농도를 측정하기 위해서 HCl을 첨가해 반응했던 NaOH보다 더 높은 농도의 NaOH 표준용액으로 역적정 하는 방법을 사용하였다. 역적정은 이번 실험에서와 같이 농도를 모르는 NaOH 용액을 농도를 아는 염산 과량에 넣은 후, 농도를 아는 NaOH 용액으로 적정을 하여 중화점을 찾아 농도를 모르는 NaOH 용액의 농도를 찾는 방법이다. 역적정을 이용해 역적정한 NaOH양을 찾고 농도를 구해본 결과 많은 오차가 발생하였다. 일단 기본적으로 농도가 음수(-)값을 가질 수 없는데 음수(-)값이 나왔다. 농도가 음수(-)값이 나온 것이 이번 실험 data에 가장 큰 영향을 미쳤는데 그 원인을 생각해보면, 첫 번째 원인은 역적정할 때 정확하게 페놀프탈레인 시약 변색때를 기준으로 역적정하지 못하고 NaOH 용액을 더 넣은 것이다. NaOH 용액을 더 넣어주게 되면 당연히 (20-보정한 NaOH양)값에서 음수(-)값이 나올 수 밖에 없다. 두 번째 원인은 역적정하기전 0.02N초산에틸과 NaOH가 반응할 때 반응이 제대로 이루어지지 않았을 것으로 생각된다. 그 이유는 초산에틸은 에스테르이기 때문에(카복실산 유도체중에 반응성이 낮은편에 속함) NaOH와의 반응이 빠르지 않다. 그러므로 반응시켜준 시간을 길게 하면 길게 할수록 반응은 더 많이 일어날 것이다. 세 번째 원인은 factor값을 구할 때 적정이 정확하게 이루어지지 않았다는 것이다. 이번 실험을 기준으로 농도가 양수(+)값이 나오게 되려면 factor값이 좀더 작게 나왔어야 했다. 그 외 다른원인은 반응이 플라스크의 가장자리부터 시작되기 때문에 최대한 가장자리 쪽의 용액을 취해야했는데 그러지 않았고 도중에 역반응이 일어났을 수도 있다고 생각한다. 일단 음수(-)값의 농도 data로 계산해 반응속도 식을 결정해보았다. 반응속도 식을 결정하는 방법은 시간에 따른 온도변화 data를 이용하는 미분법과 시간에 따른 농도의 변화 data를 이용하는 적분법이 있다. 본 실험에서는 적분법을 사용해서 반응속도 식을 결정하였다. 적분법을 이용할 때, 시간과 농도이외의 요인은 일정하게 유지해주어야 한다. 본 실험의 변수는 온도, 농도, 시간이고, 농도와 시간을 이외의 요인인 온도를 일정하게 유지하는 것이 중요하다. 따라서 항온수조를 사용하여 일정한 온도를 유지해주었다.
애초에 실험 data값이 측정불가능한 값이 나와서 각 반응차수마다 plot한 것이 정확하게 맞아떨어지지는 않지만 plot한 것을 해석해보면, 0차반응이라 예상한 경우 에서 보정한NaOH양이 점점 시간이 갈수록 줄어들기 때문에 농도가 떨어지는 그래프가 나와야 하지만 (-)부호의 농도 때문에 반대로 농도가 증가하는 그래프가 나왔다. 1차반응이라 예상한 경우 수학적으로 ln은 (/)값이 양수(+)값이 나와야 계산이 가능한데, 음수(-)값이 나와 계산이 불가능해 없는 그래프로 생각했다. 2차반응이라 예상한 경우 농도의 역수값으로 0차반응이라 예상한 경우와 반대로 (-)기울기가 나와야했지만 (-)값의 농도로 인해 (+)값의 기울기를 가진 그래프가 나왔다. 이번 실험에서는 결과값이 예상범주와 다르게 나왔지만, 실제 이상적으로 실험을 하여 농도값이 (+)값이 나온경우를 생각해보면 2차반응 그래프에서 (+)기울기 값을 가진 대체로 R값이 0.9 이상인 선형식이 나왔을 것으로 예상할 수 있다. 좀더 확실한 data값을 구하기 위해서는 첫 번째, 적정을 얼마나 정확하게 하는가에 달려있다. 그 이유는 factor값을 구할 때 그리고 역적정할 때 두곳에서 적정이 이루어지기 때문이다. 중화적정이 이루어지는 구간을 좀더 신중하게 한방울씩 적가 했으면 더 좋았겠고, 지시약을 페놀프탈레인용액 대신 BTB용액이나 다른 지시약을 이용해 정확하게 중화점을 찾는 것도 좋은 방법이 될 것이다. 두 번째, 반응시간 간격을 충분한 시간을 두고 실험을 해야한다. 초산에틸과 수산화나트륨 용액의 반응이 느리게 일어나는편이라 충분한 시간하에 반응을 다 일으켰으면 더 정확한 실험 data값을 얻었을 것이다. 세 번째, 온도의 영향도 무시할 수 없기 때문에 항온조의 온도변화가 일어났는지 확인해야한다. 네 번째, 용액을 측정하는 기구를 통일하는 것이 좋다. 비커의 눈금, 메스실린더의 눈금, 피펫의 눈금 모두 정확성이 다 다르기 때문에 측정도구를 통일해 측정오차를 줄이면 보다 정확한 data값을 얻을 수 있다고 생각한다.
8. 사용 기호
기호
단위
기호
단위
t
CH2COOC2H5의 반응 시간(min)
K,n
초기농도[mol/L]
역적정한 NaOH의 양[N]
초기 농도[N]
반응 속도 상수(1/t)
V
반응속도[농도변화량/시간변화량]
9. 참고문헌































소개글