
-
1
-
2
-
3
-
4
-
5
-
6
-
7
-
8
-
9
-
10
-
11
-
12
-
13
-
14
-
15
-
16
-
17
-
18
-
19
-
20
-
21
-
22
-
23
-
24
-
25
-
26
-
27
-
28
-
29
-
30
-
31
-
32
-
33
-
34
-
35
-
36
-
37
-
38
-
39
-
40


목차
1. 서론
1.1 Victor Meyer 방법
1.2 실험목적 및 방법
2. 이론
2.1 이상기체의 법칙
2.2 이론적 배경
2.3 기체의 분자량 측정
2.4 이상기체의 이론적 배경
2.5 역사적 배경
3. 실험
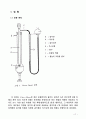
3.1 실험장치
3.2 실험방법
3.3 다른 실험방법
4. 실험결과
5. 고찰
6. 결론
§토의사항
§사용단위
§참고문헌
1.1 Victor Meyer 방법
1.2 실험목적 및 방법
2. 이론
2.1 이상기체의 법칙
2.2 이론적 배경
2.3 기체의 분자량 측정
2.4 이상기체의 이론적 배경
2.5 역사적 배경
3. 실험
3.1 실험장치
3.2 실험방법
3.3 다른 실험방법
4. 실험결과
5. 고찰
6. 결론
§토의사항
§사용단위
§참고문헌
본문내용
0=273.15K가 된다.
그리고 대기압V = 1atm, 실내의 온도T = 373.15K이므로 P = 1, T = 373.15K가 된다.
따라서 V0 =
{273.15} over {373.15} TIMES V
가 된다.
그래서 이 증기의 분자량
M=22.41g/V _{0}
으로 각각의 분자량을 계산 할 수 있다.
조 작 1
액체시료의 무게
g
0.052g
모집된 기체의 부피
V
14.4ml
실내온도
T
373.15K
대기압
P
1atm
STP에서 증기의 부피
V0
10.54ml
분자량
M
110.6g·mol
대기압을 1atm이라고 하면
V _{0} = {273.15} over {373.15} TIMES 14.4=10.54
ml 가된다.
따라서 이 증기의 문자량은
M =
22.41l TIMES 0.052g/10.54ml·mol=110.6
g·mol
조 작 2
액체시료의 무게
g
0.093g
모집된 기체의 부피
V
21.7ml
실내온도
T
378.15K
대기압
P
1atm
STP에서 증기의 부피
V0
15.88ml
분자량
M
131.2g·mol
대기압을 1atm이라고 하면
V _{0} = {273.15} over {373.15} TIMES 21.7=15.88
ml가된다.
따라서 이 증기의 문자량은
M =
22.41l TIMES 0.093g/15.88ml·mol=131.2
g·mol
조 작 3
액체시료의 무게
g
0.069g
모집된 기체의 부피
V
16.7ml
실내온도
T
373.15K
대기압
P
1atm
STP에서 증기의 부피
V0
12.22ml
분자량
M
126.5g·mol
대기압을 1atm이라고 하면
V _{0} = {273.15} over {373.15} TIMES 16.7=12.22
ml 가된다.
따라서 이 증기의 문자량은
M =
22.41l TIMES 0.069g/12.22ml·mol=126.5
g·mol
조 작 4
액체시료의 무게
g
0.073g
모집된 기체의 부피
V
17.1ml
실내온도
T
373.15K
대기압
P
1atm
STP에서 증기의 부피
V0
12.51ml
분자량
M
130.7g·mol
대기압을 1atm이라고 하면
V _{0} = {273.15} over {373.15} TIMES 17.1=12.51
ml 가된다.
따라서 이 증기의 문자량은
M =
22.41l TIMES 0.073g/12.51ml·mol=130.7
g·mol
따라서, 분자량 M의 평균값은
{110.6+131.2+126.5+130.7} over {4} =124.75
g·mol
임을 알 수 있다.
5. 고 찰
본래 실험하고자 했던 Victor Meyer 실험을 내부관 안에 휘발성 액체가 든 작은 유리공을 떨어뜨리기로 되어있었으나, 그 절차가 까다롭기 때문에 내부관에 시료를 직접 투입하는 방식을 이번 실험에서는 사용했다.
이 실험에서는 내부관의 안에서 곁가지관을 빼내어 밖에서 주사기를 사용하여 직접 투여하였다.
그래서 액체 시료의 무게를 직접 측정 할 수 없었고, 액체시료를 투여하기 전후의 주사기의 질량차이를 이용하여 간접적으로 측정하였다.
실험 중에는 증발 시료가 새어나가지 않도록 하는 것과 뷰렛과 연결부분이 응축되지 않도록 하는 것을 고려해야한다.
또, 시료를 투입하고 즉시 주사기의 질량을 측정하는 과정에서도 주의가 요구된다.
이상기체의 증기부피를 구하기 위해서는 실험을 통해 얻어진 온도와 시료가 기체로 변한 부피를 이용해 그 값을 구할 수 있다.
그리고 증기의 분자량을 이상 기체의 상태방정식에서 유도된
M=22.41g/V _{0}
를 이용해 그 값을 구할 수 있었다.
6. 결 론
이번 실험에서는 Victor Meyer 장치를 이용하여 시료(C2H5OH)의 무게를 측정한 뒤 그 시료의 양이 기체 상태에서 얼마만큼의 부피를 차지하고, 또 그 기체내에 얼마만큼의 분자량을 갖게 되는지 계산하는 실험을 행하였다.
이 실험에서 얻어지는 데이터들로 이상기체 상태방정식(PV = nRT = g / MRT)에 따른 실제기체의 분자량을 계산하여 그 오차 값을 알아 볼 수 있었고, 각각 실험조작 1,2,3,4를 통해 얻어진 분자량의 평균값을 문헌치와 비교 해 보아 대기권 부근의 모든 기체는 이상기체 상태방정식에 부합한다는 사실을 알아 낼 수 있었다.
실험에서 최종적으로 구하고자 하는 휘발성 액체의 분자량 M은
M=22.41g/V _{0}
을 이용해 그 값을 구하였다.
결과 우리는 4회 실험으로 얻어진 분자량 M값의 평균치로 124.75을 얻을 수 있었다.
토의사항
기체의 분자량 측정방법 중 가장 간편하고 정확도가 높은 Victor Meyer법을 이용하여 분자량 측정 실험을 해 보았다.
실험 시 책의 내용과 다르게 시료를 담은 작은 공 대신에 주사기를 이용하여 투입함으로서 측정된 실험장치내의 온도 하에서 시료가 기화되었을 때 얼마만큼의 부피를 갖게 되는지 알 수 있었고, 이를 통해 앞의 이론에서 설명된바 있는 식
PV=nRT
M=22.41g/V _{0}
을 통해서 분자량을 결정해 낼 수 있었다.
실험시 가스 뷰렛의 수준 조절용 밸브가 가스 뷰렛내의 수준높이와 같아지도록 조절할 때 물이 관의 내로 역류하지 않도록 주의하여 실험을 진행해야함이 이 실험에서 가장 주의할 점이고, 주사기를 이용한 시료 투입시 피스톤 내의 잔여 공기를 완전히 제거하여 정확한 시료의 양을 기록함은 정확한 실험 데이터의 기초가 되므로 신중을 기해야 했다.
사용부호
P
압력
atm
V
부피
L
T
온도
K
R
기체상수
n
몰수
mole
M
몰질량
질량
g
참고문헌
G. W. Castellan \"물리화학\" ,심구당, 7p∼15p
http://www.chemboom.com/gpc/lecture/price08a.ppt
http://www.easychem.co.kr/hwp/chem7.hwp
http://cont1.edunet4u.net/chem3s/htm/400f.htm
http://science-lab.x-y.net/science_history/physics_history/phy_his_04.htm
http://whasamo.com/web/chem2/work/1/1-2-3.htm
1987년 과학동아 5월호
그리고 대기압V = 1atm, 실내의 온도T = 373.15K이므로 P = 1, T = 373.15K가 된다.
따라서 V0 =
{273.15} over {373.15} TIMES V
가 된다.
그래서 이 증기의 분자량
M=22.41g/V _{0}
으로 각각의 분자량을 계산 할 수 있다.
조 작 1
액체시료의 무게
g
0.052g
모집된 기체의 부피
V
14.4ml
실내온도
T
373.15K
대기압
P
1atm
STP에서 증기의 부피
V0
10.54ml
분자량
M
110.6g·mol
대기압을 1atm이라고 하면
V _{0} = {273.15} over {373.15} TIMES 14.4=10.54
ml 가된다.
따라서 이 증기의 문자량은
M =
22.41l TIMES 0.052g/10.54ml·mol=110.6
g·mol
조 작 2
액체시료의 무게
g
0.093g
모집된 기체의 부피
V
21.7ml
실내온도
T
378.15K
대기압
P
1atm
STP에서 증기의 부피
V0
15.88ml
분자량
M
131.2g·mol
대기압을 1atm이라고 하면
V _{0} = {273.15} over {373.15} TIMES 21.7=15.88
ml가된다.
따라서 이 증기의 문자량은
M =
22.41l TIMES 0.093g/15.88ml·mol=131.2
g·mol
조 작 3
액체시료의 무게
g
0.069g
모집된 기체의 부피
V
16.7ml
실내온도
T
373.15K
대기압
P
1atm
STP에서 증기의 부피
V0
12.22ml
분자량
M
126.5g·mol
대기압을 1atm이라고 하면
V _{0} = {273.15} over {373.15} TIMES 16.7=12.22
ml 가된다.
따라서 이 증기의 문자량은
M =
22.41l TIMES 0.069g/12.22ml·mol=126.5
g·mol
조 작 4
액체시료의 무게
g
0.073g
모집된 기체의 부피
V
17.1ml
실내온도
T
373.15K
대기압
P
1atm
STP에서 증기의 부피
V0
12.51ml
분자량
M
130.7g·mol
대기압을 1atm이라고 하면
V _{0} = {273.15} over {373.15} TIMES 17.1=12.51
ml 가된다.
따라서 이 증기의 문자량은
M =
22.41l TIMES 0.073g/12.51ml·mol=130.7
g·mol
따라서, 분자량 M의 평균값은
{110.6+131.2+126.5+130.7} over {4} =124.75
g·mol
임을 알 수 있다.
5. 고 찰
본래 실험하고자 했던 Victor Meyer 실험을 내부관 안에 휘발성 액체가 든 작은 유리공을 떨어뜨리기로 되어있었으나, 그 절차가 까다롭기 때문에 내부관에 시료를 직접 투입하는 방식을 이번 실험에서는 사용했다.
이 실험에서는 내부관의 안에서 곁가지관을 빼내어 밖에서 주사기를 사용하여 직접 투여하였다.
그래서 액체 시료의 무게를 직접 측정 할 수 없었고, 액체시료를 투여하기 전후의 주사기의 질량차이를 이용하여 간접적으로 측정하였다.
실험 중에는 증발 시료가 새어나가지 않도록 하는 것과 뷰렛과 연결부분이 응축되지 않도록 하는 것을 고려해야한다.
또, 시료를 투입하고 즉시 주사기의 질량을 측정하는 과정에서도 주의가 요구된다.
이상기체의 증기부피를 구하기 위해서는 실험을 통해 얻어진 온도와 시료가 기체로 변한 부피를 이용해 그 값을 구할 수 있다.
그리고 증기의 분자량을 이상 기체의 상태방정식에서 유도된
M=22.41g/V _{0}
를 이용해 그 값을 구할 수 있었다.
6. 결 론
이번 실험에서는 Victor Meyer 장치를 이용하여 시료(C2H5OH)의 무게를 측정한 뒤 그 시료의 양이 기체 상태에서 얼마만큼의 부피를 차지하고, 또 그 기체내에 얼마만큼의 분자량을 갖게 되는지 계산하는 실험을 행하였다.
이 실험에서 얻어지는 데이터들로 이상기체 상태방정식(PV = nRT = g / MRT)에 따른 실제기체의 분자량을 계산하여 그 오차 값을 알아 볼 수 있었고, 각각 실험조작 1,2,3,4를 통해 얻어진 분자량의 평균값을 문헌치와 비교 해 보아 대기권 부근의 모든 기체는 이상기체 상태방정식에 부합한다는 사실을 알아 낼 수 있었다.
실험에서 최종적으로 구하고자 하는 휘발성 액체의 분자량 M은
M=22.41g/V _{0}
을 이용해 그 값을 구하였다.
결과 우리는 4회 실험으로 얻어진 분자량 M값의 평균치로 124.75을 얻을 수 있었다.
토의사항
기체의 분자량 측정방법 중 가장 간편하고 정확도가 높은 Victor Meyer법을 이용하여 분자량 측정 실험을 해 보았다.
실험 시 책의 내용과 다르게 시료를 담은 작은 공 대신에 주사기를 이용하여 투입함으로서 측정된 실험장치내의 온도 하에서 시료가 기화되었을 때 얼마만큼의 부피를 갖게 되는지 알 수 있었고, 이를 통해 앞의 이론에서 설명된바 있는 식
PV=nRT
M=22.41g/V _{0}
을 통해서 분자량을 결정해 낼 수 있었다.
실험시 가스 뷰렛의 수준 조절용 밸브가 가스 뷰렛내의 수준높이와 같아지도록 조절할 때 물이 관의 내로 역류하지 않도록 주의하여 실험을 진행해야함이 이 실험에서 가장 주의할 점이고, 주사기를 이용한 시료 투입시 피스톤 내의 잔여 공기를 완전히 제거하여 정확한 시료의 양을 기록함은 정확한 실험 데이터의 기초가 되므로 신중을 기해야 했다.
사용부호
P
압력
atm
V
부피
L
T
온도
K
R
기체상수
n
몰수
mole
M
몰질량
질량
g
참고문헌
G. W. Castellan \"물리화학\" ,심구당, 7p∼15p
http://www.chemboom.com/gpc/lecture/price08a.ppt
http://www.easychem.co.kr/hwp/chem7.hwp
http://cont1.edunet4u.net/chem3s/htm/400f.htm
http://science-lab.x-y.net/science_history/physics_history/phy_his_04.htm
http://whasamo.com/web/chem2/work/1/1-2-3.htm
1987년 과학동아 5월호
























































소개글