본문내용
281333
0.43834
153.9409
-2.18735
0.358189
5
0.002861
0.942822
1.060645
349.4874
-2.54343
-0.02557
6
0.00232
0.473667
2.111189
431.0345
-2.63451
-0.32453
Graph
γ Vs. CB,eq
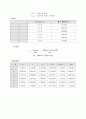
구 분
CB,eq
γ
1
0.05452
5.123333
2
0.036733
4.954167
3
0.021035
3.956889
4
0.006496
2.281333
5
0.002861
0.942822
6
0.00232
0.473667
1/γ Vs. 1/CB,eq
구 분
1/γ
1/CB,eq
1
0.195185
18.34189
2
0.20185
27.22323
3
0.252724
47.54057
4
0.43834
153.9409
5
1.060645
349.4874
6
2.111189
431.0345
log CB,eq Vs. logγ
구 분
log CB,eq
logγ
1
-1.26344
0.709553
2
-1.43494
0.694971
3
-1.67706
0.597354
4
-2.18735
0.358189
5
-2.54343
-0.02557
6
-2.63451
-0.32453
● Discussion
이번 실험은 Citric Acid의 활성탄(activated carbon)에 대한 흡착양상을 관찰했다. 또 그 결과를 계산하여 실험결과가 Langmuir 흡착 등온식에 얼마나 잘 부합하는지를 Graph로 도시해 봄으로써 살펴보았다.
Data 1, 2에서는 그 값을 비교하기 힘들지만, 이를 계산하여 얻은 값을 도시한 graph들을 살펴보면 그 흡착양상을 파악할 수 있으며, 그 흡착경향이 거의 선형을 이룸을 알 수 있다.
실험은 Citric Acid를 여러 가지 농도에서 흡착정도를 관찰하였는데(프로인드리히 흡착등온식, absorption isotherms) graph를 보면 높은 농도(flask no. 1, 2, 3)에서보다 낮은 농도(flask no. 4, 5, 6)에서 더 부드러운 선형을 보였다.
이렇게 나타나는 이유는 Langmuir 흡착 등온식의 이론에서 설명했듯, 모든 입자간 방해를 무시할 수 있는 매우 묽은 농도 범위에서 Langmuir 흡착 등온식이 더 잘 성립하기 때문이라고 생각된다.
이번 실험이 정확한 값을 얻기 위한 실험이라기보다 농도 변화에 따라 흡착양상을 알아보는 실험이지만이지만 오차가 생길 수 있는 원인을 생각해보면
1) 평형을 이루는 시간의 부족
: 보다 충분한 시간을 확보하는 것이 흡착양상을 더 잘 이해할 수 있을 것이다.
2) 적정시 생기는 오차
: 적정시에 눈금을 보는 개인오차, 또 불순물에 의한 실험오차
3) 불순물에 의한 오차
4) 시약의 변질에 따른 오차 등이 있다.
● Reference
물리화학실험, 대한화학회, 청문각, 1999
물리화학, LaidlerMeiser, 자유아카데미, 1997
Handbook of Physical&Chemistry, CRC 75th
화학반응속도론, 이덕수, 동화기행
0.43834
153.9409
-2.18735
0.358189
5
0.002861
0.942822
1.060645
349.4874
-2.54343
-0.02557
6
0.00232
0.473667
2.111189
431.0345
-2.63451
-0.32453
Graph
γ Vs. CB,eq
구 분
CB,eq
γ
1
0.05452
5.123333
2
0.036733
4.954167
3
0.021035
3.956889
4
0.006496
2.281333
5
0.002861
0.942822
6
0.00232
0.473667
1/γ Vs. 1/CB,eq
구 분
1/γ
1/CB,eq
1
0.195185
18.34189
2
0.20185
27.22323
3
0.252724
47.54057
4
0.43834
153.9409
5
1.060645
349.4874
6
2.111189
431.0345
log CB,eq Vs. logγ
구 분
log CB,eq
logγ
1
-1.26344
0.709553
2
-1.43494
0.694971
3
-1.67706
0.597354
4
-2.18735
0.358189
5
-2.54343
-0.02557
6
-2.63451
-0.32453
● Discussion
이번 실험은 Citric Acid의 활성탄(activated carbon)에 대한 흡착양상을 관찰했다. 또 그 결과를 계산하여 실험결과가 Langmuir 흡착 등온식에 얼마나 잘 부합하는지를 Graph로 도시해 봄으로써 살펴보았다.
Data 1, 2에서는 그 값을 비교하기 힘들지만, 이를 계산하여 얻은 값을 도시한 graph들을 살펴보면 그 흡착양상을 파악할 수 있으며, 그 흡착경향이 거의 선형을 이룸을 알 수 있다.
실험은 Citric Acid를 여러 가지 농도에서 흡착정도를 관찰하였는데(프로인드리히 흡착등온식, absorption isotherms) graph를 보면 높은 농도(flask no. 1, 2, 3)에서보다 낮은 농도(flask no. 4, 5, 6)에서 더 부드러운 선형을 보였다.
이렇게 나타나는 이유는 Langmuir 흡착 등온식의 이론에서 설명했듯, 모든 입자간 방해를 무시할 수 있는 매우 묽은 농도 범위에서 Langmuir 흡착 등온식이 더 잘 성립하기 때문이라고 생각된다.
이번 실험이 정확한 값을 얻기 위한 실험이라기보다 농도 변화에 따라 흡착양상을 알아보는 실험이지만이지만 오차가 생길 수 있는 원인을 생각해보면
1) 평형을 이루는 시간의 부족
: 보다 충분한 시간을 확보하는 것이 흡착양상을 더 잘 이해할 수 있을 것이다.
2) 적정시 생기는 오차
: 적정시에 눈금을 보는 개인오차, 또 불순물에 의한 실험오차
3) 불순물에 의한 오차
4) 시약의 변질에 따른 오차 등이 있다.
● Reference
물리화학실험, 대한화학회, 청문각, 1999
물리화학, LaidlerMeiser, 자유아카데미, 1997
Handbook of Physical&Chemistry, CRC 75th
화학반응속도론, 이덕수, 동화기행



























소개글