목차
1. purpose
2. Regents & apparatus
3. Theory
4. Method
5. Result
6. Discussion
7. Reference
2. Regents & apparatus
3. Theory
4. Method
5. Result
6. Discussion
7. Reference
본문내용
있는 coolimeter에 의해 가는 선다발이 되어 시료에 입사된다. 입사 x-ray가 투과 반사되는 위치에 평판 film을 놓고 회절 x-ray를 얻어 회절각 2θ는 다음식에 너허 구할 수 있다.
투과법 : 2θ = tan-1 X/D
반사법 : 180-2θ = tan-1 X/D
(X : Debye ring 반경, D : 시료와 film사이의 거리)
5) Debye - Scherrer camera
시료는 내경 0.3~1nm의 모세관 유리에 넣거나 glass fiber주위에 부착시켜서 camera중심부에 설치한다. 보통 시료는 회절, 진동시켜서 회절에 기여하는 결정이 많게하여 Debey-ring의 평균화가 되도록 해 배향의 영향을 무시 할 수 있게 한다. Diffratometer가 간편하고 감도의 측정도 쉬운데 반해서 Debye - Scherrer camera 는 film처리가 어렵고 감도의 정량성이 어렵다. 따라서 이 camera는 시료의 양이 적은 경우에 좋고, 배향성이 있는 시료에 적합하다.
*MOF-5의 pore에 nitrogen의 흡착
MOF-5는 구조물의 표면이 뚜렷하게 표현되고 구조내에 공간적 부피도 있는 pore에 기체를 흡착시킬 수 있어서 유용하게 평가되고 있다. 흡착물로 N2를 하면 gas와 증기상을 수착 후 탈용매화된 sample을 전기적 마이크로 단위의 측정이 가능한 중량기를 이용하여 분석을 해본결과 N2의 흡착을 가역적반응으로 진행되며 large crystals(0.2mm)와 Microcrystals(30μm)가 함께 포함되어있다.
4. Method
1) Zn(NO3)24H2O 0.83g + H2BDC 0.176g을 DEF 10ml에 녹인다.
2) 100℃로 20 시간 가열
3) 용약을 따르고 결정을 DMF로 씻는다.
4) CHCl3로 3일동안 exchange 한다.
5) 이물질을 6시간동안 125℃에서 evacuated한다.
6) 833m2/g의 smaple을 얻는다.
5. Result
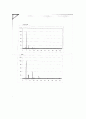
1)TGA
첫 번째 클로로포름을 넣기전에는 용매가 52%정도이고 MOF-5는 27%의 질량감소를 보였다. 두 번째 클로로포름을 해주고 TGA를 보면 용매부분이 60%로 두 번째 분석시 클로로포름이 많이 포함되어 있었음을 예측 해 볼 수 있다. MOF-5의 무게분율은 27~26&로 이론적인 수율을 고려해보면(56%) 거의 일치한다고 말할 수 있다. 질량감소 온도구간은 400~500도로 나와있는데 그래프에서도 같은 감소구간을 보여 tGa분석에서는 올바른 결과를 얻었다고 하겠다.
구간이 두 개 나오는 이유는 용매가 날라가 질량감소를 겪은 후 MOF-5의 질량감소가 나타나기 때문이다. 클로로포름을 넣은 여부에 따라 그래프가 조금 다른 것은 두 용매의 끓는점이 달라서 그런 것이다. 마지막으로 다 타고 나서 남는 것은 금속산화물인 ZnO4이다.
2)PXRD
시뮬레이터 결과와 비교해보면 이론상의 peak를 포함하고는 있지만 분순물로 보이는 여러개의 peak가 관찰되었다. 불순물이 있지만 우리가 합성한 화합물이 MOF-5를 포함하고 있다는 것을 확인하였다. PXRD는 양보다는 peak의 위치에 더 주목해야 한다. 불순물의 원인은 시료분석시 충분히 건조시키지 않았거나 합성되지 못한 반응물로 생각해 볼 수 있다. PXRD는 각도에 따라 peak 값이 나오는데 적당한 결정으로 갈아주어야 한다. 갈아주는 과정에서도 오차에 대한 원인으로 생각해 볼 수 있다.
3)질소흡착
흡착조건은 용매를 날리기 위하여 80도와 진공조건에서 2시간 동안의 activation과정을 거쳐서 pore내부를 완전히 비우게 한 후 -195도에서 질소의 흡착량을 계산한 값을 얻었다.
논문자료에서 보면 최대 흡착량은 4031.2m2/g이 된다. 실제 이론값은 2833(m2/g)으로 나와 있으며 이는 계산과정에서 BET법과 Langmuir법으로 계산했을 때가 다르기 때문이다. 그 외에도 용매에 대한 원인도 생각해 볼 수 있다. BET의 경우에는 단분자 층을 이루고 있고 Langmuir의 경우에는 multilayer를 이루고 있다. N2등온선은 특정한 흡착점에서만 흡착이 일어나는 경우로서 합성한 물질보다 이론상이 pore보다 작고 압력과 무관하게 흡착량이 일정한 부분이 단분자층 흡착량이 되는 형태로 흡착세기가 크다. pore가 크다고 표면적이 큰 것은 아니지만 우리가 합성한 MOF-5가 완전하지는 않음을 확인하였다.
6. Discussion
이번실험을 유기금속화합물의 성질을 이해하고 내부에 pore가 있는 다고엇ㅇ 물질을 합성하고 물성을 파악하는 실험이다. 안전하면서도 다공성 골격을 확인하였고 스스로 실험하면서 많은 것은 직접 확인해볼 수 있었다. 분석은 크게 3가지 방법으로 이루어졌는데 TGA에서는 질량감소 온도구간을 확인해 봄으로써 우리가 합성한 MOF-5가 어느정도 수율로 존재한다는 것을 보았고 이는 hole의 용매가 타고나서 리간드가 열에의해 깨어지면서 질량감소하는 구간을 보여주었기 EOans에 알 수 있는 것이다. 용매를 확실히 처리해주지 않으면 첫 번째 질량감소 부근에서 60%가까이 무게분율이 나오게 되어 데이터에 영향을 준다. PXRD 실험에서는 잔여 peak가 있기는 하지만 peak면적은 크게 고려치 않아도 됨을 생각하면 우리가 합성한 물질에는 MOF-5가 있음을 알 수 있었다. 얼마나 잘 만들어졌는지는 질소를 흡착하여 알 수 있었는데 이론치 보다 작게 흡착되었다. 이는 합성은 되었으나 pore가 제대로 자리잡지 못한 것이다. 결정을 관찰해 보았을때 cubic모양이 깨어지고 붙어 있고 하였는데 이는 결정이 성장하면서 두 개의 결정이 같이 붙어 성장하거나 합성과정에서 충격으로 깨어져서 결정의 모양에 변화가 있게된다. 이러한 요인들이 pore의 크기를 변화시켜서 흡착량에 이론치에 대하여 변화가 있지 않았나 생각된다. 우리실험에서 흡착등온선은 type1이며 화학흡착이다. PXRD분석결과로 같은 peak를 포함하고 있음을 볼 때 MOF-5합성이 비교적 올바르게 이루어졌음을 확인 할 수 있었다.
7. Reference
Inorganic chemistry Gray L miessler pearson
투과법 : 2θ = tan-1 X/D
반사법 : 180-2θ = tan-1 X/D
(X : Debye ring 반경, D : 시료와 film사이의 거리)
5) Debye - Scherrer camera
시료는 내경 0.3~1nm의 모세관 유리에 넣거나 glass fiber주위에 부착시켜서 camera중심부에 설치한다. 보통 시료는 회절, 진동시켜서 회절에 기여하는 결정이 많게하여 Debey-ring의 평균화가 되도록 해 배향의 영향을 무시 할 수 있게 한다. Diffratometer가 간편하고 감도의 측정도 쉬운데 반해서 Debye - Scherrer camera 는 film처리가 어렵고 감도의 정량성이 어렵다. 따라서 이 camera는 시료의 양이 적은 경우에 좋고, 배향성이 있는 시료에 적합하다.
*MOF-5의 pore에 nitrogen의 흡착
MOF-5는 구조물의 표면이 뚜렷하게 표현되고 구조내에 공간적 부피도 있는 pore에 기체를 흡착시킬 수 있어서 유용하게 평가되고 있다. 흡착물로 N2를 하면 gas와 증기상을 수착 후 탈용매화된 sample을 전기적 마이크로 단위의 측정이 가능한 중량기를 이용하여 분석을 해본결과 N2의 흡착을 가역적반응으로 진행되며 large crystals(0.2mm)와 Microcrystals(30μm)가 함께 포함되어있다.
4. Method
1) Zn(NO3)24H2O 0.83g + H2BDC 0.176g을 DEF 10ml에 녹인다.
2) 100℃로 20 시간 가열
3) 용약을 따르고 결정을 DMF로 씻는다.
4) CHCl3로 3일동안 exchange 한다.
5) 이물질을 6시간동안 125℃에서 evacuated한다.
6) 833m2/g의 smaple을 얻는다.
5. Result
1)TGA
첫 번째 클로로포름을 넣기전에는 용매가 52%정도이고 MOF-5는 27%의 질량감소를 보였다. 두 번째 클로로포름을 해주고 TGA를 보면 용매부분이 60%로 두 번째 분석시 클로로포름이 많이 포함되어 있었음을 예측 해 볼 수 있다. MOF-5의 무게분율은 27~26&로 이론적인 수율을 고려해보면(56%) 거의 일치한다고 말할 수 있다. 질량감소 온도구간은 400~500도로 나와있는데 그래프에서도 같은 감소구간을 보여 tGa분석에서는 올바른 결과를 얻었다고 하겠다.
구간이 두 개 나오는 이유는 용매가 날라가 질량감소를 겪은 후 MOF-5의 질량감소가 나타나기 때문이다. 클로로포름을 넣은 여부에 따라 그래프가 조금 다른 것은 두 용매의 끓는점이 달라서 그런 것이다. 마지막으로 다 타고 나서 남는 것은 금속산화물인 ZnO4이다.
2)PXRD
시뮬레이터 결과와 비교해보면 이론상의 peak를 포함하고는 있지만 분순물로 보이는 여러개의 peak가 관찰되었다. 불순물이 있지만 우리가 합성한 화합물이 MOF-5를 포함하고 있다는 것을 확인하였다. PXRD는 양보다는 peak의 위치에 더 주목해야 한다. 불순물의 원인은 시료분석시 충분히 건조시키지 않았거나 합성되지 못한 반응물로 생각해 볼 수 있다. PXRD는 각도에 따라 peak 값이 나오는데 적당한 결정으로 갈아주어야 한다. 갈아주는 과정에서도 오차에 대한 원인으로 생각해 볼 수 있다.
3)질소흡착
흡착조건은 용매를 날리기 위하여 80도와 진공조건에서 2시간 동안의 activation과정을 거쳐서 pore내부를 완전히 비우게 한 후 -195도에서 질소의 흡착량을 계산한 값을 얻었다.
논문자료에서 보면 최대 흡착량은 4031.2m2/g이 된다. 실제 이론값은 2833(m2/g)으로 나와 있으며 이는 계산과정에서 BET법과 Langmuir법으로 계산했을 때가 다르기 때문이다. 그 외에도 용매에 대한 원인도 생각해 볼 수 있다. BET의 경우에는 단분자 층을 이루고 있고 Langmuir의 경우에는 multilayer를 이루고 있다. N2등온선은 특정한 흡착점에서만 흡착이 일어나는 경우로서 합성한 물질보다 이론상이 pore보다 작고 압력과 무관하게 흡착량이 일정한 부분이 단분자층 흡착량이 되는 형태로 흡착세기가 크다. pore가 크다고 표면적이 큰 것은 아니지만 우리가 합성한 MOF-5가 완전하지는 않음을 확인하였다.
6. Discussion
이번실험을 유기금속화합물의 성질을 이해하고 내부에 pore가 있는 다고엇ㅇ 물질을 합성하고 물성을 파악하는 실험이다. 안전하면서도 다공성 골격을 확인하였고 스스로 실험하면서 많은 것은 직접 확인해볼 수 있었다. 분석은 크게 3가지 방법으로 이루어졌는데 TGA에서는 질량감소 온도구간을 확인해 봄으로써 우리가 합성한 MOF-5가 어느정도 수율로 존재한다는 것을 보았고 이는 hole의 용매가 타고나서 리간드가 열에의해 깨어지면서 질량감소하는 구간을 보여주었기 EOans에 알 수 있는 것이다. 용매를 확실히 처리해주지 않으면 첫 번째 질량감소 부근에서 60%가까이 무게분율이 나오게 되어 데이터에 영향을 준다. PXRD 실험에서는 잔여 peak가 있기는 하지만 peak면적은 크게 고려치 않아도 됨을 생각하면 우리가 합성한 물질에는 MOF-5가 있음을 알 수 있었다. 얼마나 잘 만들어졌는지는 질소를 흡착하여 알 수 있었는데 이론치 보다 작게 흡착되었다. 이는 합성은 되었으나 pore가 제대로 자리잡지 못한 것이다. 결정을 관찰해 보았을때 cubic모양이 깨어지고 붙어 있고 하였는데 이는 결정이 성장하면서 두 개의 결정이 같이 붙어 성장하거나 합성과정에서 충격으로 깨어져서 결정의 모양에 변화가 있게된다. 이러한 요인들이 pore의 크기를 변화시켜서 흡착량에 이론치에 대하여 변화가 있지 않았나 생각된다. 우리실험에서 흡착등온선은 type1이며 화학흡착이다. PXRD분석결과로 같은 peak를 포함하고 있음을 볼 때 MOF-5합성이 비교적 올바르게 이루어졌음을 확인 할 수 있었다.
7. Reference
Inorganic chemistry Gray L miessler pearson





























소개글