본문내용
용하기 때문에 센 산의 경우에 비해 약간 복잡하다. 식초의 초기 pH는 2.58로
거기서부터 계산해 보면 이다. 이때 의 산해리 상수는
Ka==1.74 × 10-5로 여기서 의 값이 M이므로 =1.74 × 10-5를 계산하면 식초의 원래농도 x는 약 3.98M이다.
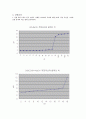
3. 센 산인 HCl을 센 염기인 NaOH로 적정했을 때 약산인 를 센 염기인
NaOH로 적정했을 때 종말점에서의pH는 각각 얼마인가? 또 두 경우에 적정 곡선의 모
양이 다른 이유는 무엇인가?
종말점에서의 pH는 10.2와 10.4이었다.
이 두 경우의 적정 곡선이 다른 이유는, HCl의 경우 강산으로 100% 해리되어 NaOH
와 반응하여 아주 표준적인 적정 곡선을 만들지만, 아세트산의 경우 극히 일부만 해리되고
또한 버퍼용액처럼 반응하여 더 늦게 pH의 변화가 일어날 뿐만 아니라 7.0에서 벗어난
당량점에서의 pH값과 종말점을 얻게된다.
4.의 이온화 상수(산해리 상수)를 구하라.
의 산해리 상수는 문헌값으로 1.74 × 10-5로 나타나 있지만, 무리의 실
험결과로도 계산해 볼 수 있을 것이다.(단 초기의 농도를 알아야 하므로 위의 2.의 계
산에 따라 의 초기농도를 3.98M이라고 가정한다. 또한 실험결과에서 종말
점을 당량점에 근사한다고 가정하고 NaOH를 22ml 첨가했을 때로 가정한다.) 이때 수
용액에는 2.2mmol의 가 발생한다. 이것이 전부 에 의해 중화되므로 의
양은 역시 2.2mmol 일 것이다. 초기농도와 부피에 의해 의 양이
79.6mmol인 것을 알 수 있고 거기서 다시 계산해보면 이라는 상당히 오차가 큰 산
해리 상수가 나왔다. 아마도 오차의 원인은 당량점의 위치를 잘못 잡은 것에 의할 것이
다.
5.산의 농도를 지시약의 종말점으로 구한 것과 pH 미터에 의한 방법(당량점)으로 구할 때의 오차를 계산해보라.
HCl로 계산해 볼 경우 종말점은 NaOH를 약 20ml 첨가했을 때였다. 그러나, 그 지점에서의 pH는 2.69로 당량점과 상당한 차이가 있다. 그러나 실재로 그 오차를 계산해 보면, NV=N’V’의 공식에 V=20ml, N’=0.1M, V’= 20ml을 대입해보면, HCl의 농도 N은 0.1M이라는 결과가 나온다. 당량점으로부터 구한 HCl의 농도는 위의 2.의 계산에 따라 0.0875M로 그 차이는 불과 0.0125밖에 안 나타난다. 그것은 적정시 pH의 변화가 아주 급격하게 변하기 때문인 것이다.
거기서부터 계산해 보면 이다. 이때 의 산해리 상수는
Ka==1.74 × 10-5로 여기서 의 값이 M이므로 =1.74 × 10-5를 계산하면 식초의 원래농도 x는 약 3.98M이다.
3. 센 산인 HCl을 센 염기인 NaOH로 적정했을 때 약산인 를 센 염기인
NaOH로 적정했을 때 종말점에서의pH는 각각 얼마인가? 또 두 경우에 적정 곡선의 모
양이 다른 이유는 무엇인가?
종말점에서의 pH는 10.2와 10.4이었다.
이 두 경우의 적정 곡선이 다른 이유는, HCl의 경우 강산으로 100% 해리되어 NaOH
와 반응하여 아주 표준적인 적정 곡선을 만들지만, 아세트산의 경우 극히 일부만 해리되고
또한 버퍼용액처럼 반응하여 더 늦게 pH의 변화가 일어날 뿐만 아니라 7.0에서 벗어난
당량점에서의 pH값과 종말점을 얻게된다.
4.의 이온화 상수(산해리 상수)를 구하라.
의 산해리 상수는 문헌값으로 1.74 × 10-5로 나타나 있지만, 무리의 실
험결과로도 계산해 볼 수 있을 것이다.(단 초기의 농도를 알아야 하므로 위의 2.의 계
산에 따라 의 초기농도를 3.98M이라고 가정한다. 또한 실험결과에서 종말
점을 당량점에 근사한다고 가정하고 NaOH를 22ml 첨가했을 때로 가정한다.) 이때 수
용액에는 2.2mmol의 가 발생한다. 이것이 전부 에 의해 중화되므로 의
양은 역시 2.2mmol 일 것이다. 초기농도와 부피에 의해 의 양이
79.6mmol인 것을 알 수 있고 거기서 다시 계산해보면 이라는 상당히 오차가 큰 산
해리 상수가 나왔다. 아마도 오차의 원인은 당량점의 위치를 잘못 잡은 것에 의할 것이
다.
5.산의 농도를 지시약의 종말점으로 구한 것과 pH 미터에 의한 방법(당량점)으로 구할 때의 오차를 계산해보라.
HCl로 계산해 볼 경우 종말점은 NaOH를 약 20ml 첨가했을 때였다. 그러나, 그 지점에서의 pH는 2.69로 당량점과 상당한 차이가 있다. 그러나 실재로 그 오차를 계산해 보면, NV=N’V’의 공식에 V=20ml, N’=0.1M, V’= 20ml을 대입해보면, HCl의 농도 N은 0.1M이라는 결과가 나온다. 당량점으로부터 구한 HCl의 농도는 위의 2.의 계산에 따라 0.0875M로 그 차이는 불과 0.0125밖에 안 나타난다. 그것은 적정시 pH의 변화가 아주 급격하게 변하기 때문인 것이다.


























소개글