목차
TABLE OF CONTENTS --------------------------------------------Ⅰ
LIST OF FIGURES & TABLES --------------------------------------Ⅱ
ABSTRACT -------------------------------------------------------Ⅲ
1. INTRODUCTION ------------------------------------------------1
1.1. 반응속도식---------------------------------------------------1
1.1.1. 반응속도식의 정의 ------------------------------------------1
1.1.2. 반응차수 --------------------------------------------------1
1.1.3. 반응속도 상수 ---------------------------------------------2
1.2. 회분식 반응기에 대한 해석 -------------------------------------3
1.2.1. 미분법 ---------------------------------------------------3
1.2.2. 적분법 ---------------------------------------------------4
1.3. 회분식과 반회분식 반응기 --------------------------------------4
1.4. 실험목적 ----------------------------------------------------5
2. EXPERIMENTAL ------------------------------------------------6
2.1. 실험 기구 ---------------------------------------------------6
2.2. 실험 방법 ---------------------------------------------------6
3. RESULTS & DISCUSSION ----------------------------------------7
3.1. Result ------------------------------------------------------7
3.1.1. 실험 -----------------------------------------------------7
3.2. Discussion --------------------------------------------------18
4. Conclusion ------------------------------------------------------19
5. REFERENCES ---------------------------------------------------20
LIST OF FIGURES
Figure 1. CA vs Time 그래프(25℃) ----------------------------------11
Figure 2. ln(CAo/CA) vs Time 그래프(25℃) ---------------------------12
Figure 3. (1/CA) vs Time 그래프(25℃) -------------------------------13
Figure 4. -dCA/dt vs CA 그래프(25℃) -------------------------------14
Figure 5. ln(-dCA/dt) vs ln(CA) 그래프(25℃) --------------------------15
Figure 6. ln(CAo/CA) vs Time 그래프(34℃) ---------------------------16
Figure 7. ln(CAo/CA) vs Time 그래프(45℃)----------------------------17
LIST OF TABLES
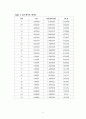
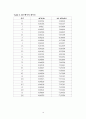
Table 1. 25℃에서의 데이터 ------------------------------------------7
Table 2. 34℃에서의 데이터 ------------------------------------------8
Table 3. 45℃에서의 데이터 ------------------------------------------9
Table 4. 25℃에서의 데이터 ------------------------------------------10
LIST OF FIGURES & TABLES --------------------------------------Ⅱ
ABSTRACT -------------------------------------------------------Ⅲ
1. INTRODUCTION ------------------------------------------------1
1.1. 반응속도식---------------------------------------------------1
1.1.1. 반응속도식의 정의 ------------------------------------------1
1.1.2. 반응차수 --------------------------------------------------1
1.1.3. 반응속도 상수 ---------------------------------------------2
1.2. 회분식 반응기에 대한 해석 -------------------------------------3
1.2.1. 미분법 ---------------------------------------------------3
1.2.2. 적분법 ---------------------------------------------------4
1.3. 회분식과 반회분식 반응기 --------------------------------------4
1.4. 실험목적 ----------------------------------------------------5
2. EXPERIMENTAL ------------------------------------------------6
2.1. 실험 기구 ---------------------------------------------------6
2.2. 실험 방법 ---------------------------------------------------6
3. RESULTS & DISCUSSION ----------------------------------------7
3.1. Result ------------------------------------------------------7
3.1.1. 실험 -----------------------------------------------------7
3.2. Discussion --------------------------------------------------18
4. Conclusion ------------------------------------------------------19
5. REFERENCES ---------------------------------------------------20
LIST OF FIGURES
Figure 1. CA vs Time 그래프(25℃) ----------------------------------11
Figure 2. ln(CAo/CA) vs Time 그래프(25℃) ---------------------------12
Figure 3. (1/CA) vs Time 그래프(25℃) -------------------------------13
Figure 4. -dCA/dt vs CA 그래프(25℃) -------------------------------14
Figure 5. ln(-dCA/dt) vs ln(CA) 그래프(25℃) --------------------------15
Figure 6. ln(CAo/CA) vs Time 그래프(34℃) ---------------------------16
Figure 7. ln(CAo/CA) vs Time 그래프(45℃)----------------------------17
LIST OF TABLES
Table 1. 25℃에서의 데이터 ------------------------------------------7
Table 2. 34℃에서의 데이터 ------------------------------------------8
Table 3. 45℃에서의 데이터 ------------------------------------------9
Table 4. 25℃에서의 데이터 ------------------------------------------10
본문내용
0.000641
-7.352481
13
0.000697
-7.268725
13.5
0.000778
-7.158784
figure 1. CA vs Time 그래프(25℃)
figure 2. ln(CAo/CA) vs Time 그래프(25℃)
figure 3. (1/CA) vs Time 그래프(25℃)
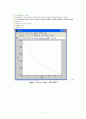
그래프가 직선과 가장 가까운 모습을 나타내면서 직선추세선과 많이 일치하는 모습을 보인다. 이를 바탕으로 이번 실험에 사용한 화학반응의 차수는 2차임을 알 수 있다.
figure 4. -dCA/dt vs CA 그래프(25℃)
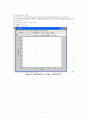
이 그래프는 25℃일 때 농도(CA)와 시간에 따른 농도변화량(-dCA/dt)을 그래프로 나타낸 것이다. 이 그래프는 일반적인 1차 반응 속도식을 나타낸 것이다. 농도가 증가할수록 농도변화량이 증가하는 것을 볼 수 있다. 시간에 따른 농도 변화량이 증가하는 모습을 보인다.
figure 5. ln(-dCA/dt) vs ln(CA) 그래프(25℃)
이 그래프는 미분법을 사용하여 자료해석을 위해 나타낸 그래프로 이 그래프의 기울기는 반응차수에 해당된다. 이 그래프는 거의 직선이다. 이론적인 선형추세선과는 약간 차이가 발생하였다.
figure 6. ln(CAo/CA) vs Time 그래프(34℃)
34℃에서 2차 반응으로 가정하여 계산한 식에서 나온 그래프와 비교시 1차 반응가정 그래프는 선형 추세선과는 많은 차이를 보이므로 반응이 정확히 1차가 아님을 알 수 있다.
figure 7. ln(CAo/CA) vs Time 그래프(45℃)
45℃에서 2차 반응으로 가정하여 계산한 식에서 나온 그래프와 비교 시 1차 반응가정 그래프는 선형 추세선과는 많은 차이를 보이므로 반응이 정확히 1차가 아님을 알 수 있다.
3.2. Discussion
이번 실험은 에틸아세테이트와 NaOH가 화학반응을 통해 반응 속도 상수와 반응 차수를 알아보는 실험이었다. 에틸아세테이트와 NaOH의 반응은 반응을 하면 pH와 전도도가 변화하는데 전도도가 변화하는 것을 확인하여 반응의 농도를 계산하고 반응의 진행정도를 실시간으로 확인이 가능 하였다. 반응차수는 온도에 관계없이 거의 일정하게 2정도의 값을 나타내었다. 25℃의 반응차수를 알아보기 위하여 먼저 적분법을 사용하여 알아보면 (CA0/CA) vs t와 1/CA vs t의 그래프 두 개를 그리고, 직선적인 추세선을 그려서 추세선과 가장 가까운 값을 가지는 그래프를 확인해 보았다. (CA0/CA) vs t는 그래프의 형태가 로그함수적인 형태를 띄었고, 1/CA vs t의 그래프는 직선적인 형태를 띄었다. 그 결과 1차 반응을 나타내는 (CA0/CA) vs t보다는 2차 반응을 나타내는 1/CA vs t의 그래프가 직선 추세선과 더 잘 맞아 떨어졌다. 이러한 결과를 보아서 이 반응은 2차 반응이라는 것을 추측할 수 있었다. 34℃의 반응차수도 25℃와 같은 방법으로 데이터를 분석하였을 때 결과도 25℃와 비슷하게 나타났다. 45℃의 반응차수 역시 25℃와 같은 방법으로 데이터를 분석하였고, 결과 역시 비슷한 값이 나오는 것을 알 수 있었다.
2차 반응을 나타내는 추세선과 거의 비슷한 그래프가 나오지만 거의 일치하는 것도 있었지만 그렇지 않은 그래프도 있었다. 그 이유로는 반응기가 온도를 잘 제어하지 못해서 인 것 같다. 반응을 하는 동안에도 온도가 일정하게 유지되는 것이 아니라 조금씩의 변화가 생겼다. 반응이 온도에 민감했다고 한다면 약간의 온도차이로도 큰 오차가 생겼을 것이라고 생각된다. 또한 반응이 완벽히 일어나지 않아 반응차수가 차이가 생겼을 가능성이 있고 세척을 하고 남아있던 증류수가 NaOH의 농도를 묽게 만들어 오차가 생겼을 수도 있다고 생각된다.
4. Conclusion
이 실험은 회분식 반응기를 사용하여 반응이 일어남에 따라 전도도와 pH가 변하는 실험을 통하여 반응 속도 상수와 반응차수를 알아보는 실험이었다. 실험은 0.04M의 NaOH용액을 넣어주고 안정이 되면 에틸아세테이트를 5㎖를 넣어주어 교반하면서 전도도와 pH를 측정하였다. 온도가 25℃, 34℃, 45℃ 일 때 3번에 걸쳐서 실험을 하였다. 온도가 높아질수록 반응이 빨리 끝나서 전도도가 줄어들어 서서히 일정해지는 모습을 보이는 시간이 온도가 높을수록 짧아짐을 알 수 있었다. 반응차수는 온도에 관계없이 거의 일정하게 2정도의 값을 나타내었다. 25℃의 반응차수를 알아보기 위하여 먼저 적분법을 사용하여 알아보면 (CA0/CA) vs t와 1/CA vs t의 그래프 두 개를 그리고, 직선적인 추세선을 그려서 추세선과 가장 가까운 값을 가지는 그래프를 확인해 보았다. (CA0/CA) vs t는 그래프의 형태가 로그함수적인 형태를 띄었고, 1/CA vs t의 그래프는 직선적인 형태를 띄었다. 그 결과 1차 반응을 나타내는 (CA0/CA) vs t보다는 2차 반응을 나타내는 1/CA vs t의 그래프가 직선 추세선과 더 잘 맞아 떨어졌다. 이러한 결과를 보아서 이 반응은 2차 반응이라는 것을 추측할 수 있었다. 34℃의 반응차수도 25℃와 같은 방법으로 데이터를 분석하였을 때 결과도 25℃와 비슷하게 나타났다. 45℃의 반응차수 역시 25℃와 같은 방법으로 데이터를 분석하였고, 결과 역시 비슷한 값이 나오는 것을 알 수 있었다.
2차 반응을 나타내는 추세선과 거의 비슷한 그래프가 나오지만 거의 일치하는 것도 있었지만 그렇지 않은 그래프도 있었다. 그 이유로는 반응기가 온도를 잘 제어하지 못해서 인 것 같다. 반응을 하는 동안에도 온도가 일정하게 유지되는 것이 아니라 올라갔다가 내려갔다가 하면서 조금씩의 변화가 생겼다. 반응이 온도에 민감하다고 한다면 약간의 온도차이로도 큰 오차가 생겼을 것이라고 생각된다. 또한 반응기내에서 반응이 완벽히 일어나지 않아 반응차수가 차이가 생겼을 가능성이 있고, 반응기에 세척을 하고 남아있던 증류수가 NaOH의 농도를 묽게 만들어 오차가 생겼을 수도 있다고 생각된다.
5. Reference
[1] 화학 공학 개론, 1st ed, 동화 기술, 고완석, 김영준, 임계규, 209-219
[2] 화학반응공학, 동화기술, 홍연기외 4명, 82-85
-7.352481
13
0.000697
-7.268725
13.5
0.000778
-7.158784
figure 1. CA vs Time 그래프(25℃)
figure 2. ln(CAo/CA) vs Time 그래프(25℃)
figure 3. (1/CA) vs Time 그래프(25℃)
그래프가 직선과 가장 가까운 모습을 나타내면서 직선추세선과 많이 일치하는 모습을 보인다. 이를 바탕으로 이번 실험에 사용한 화학반응의 차수는 2차임을 알 수 있다.
figure 4. -dCA/dt vs CA 그래프(25℃)
이 그래프는 25℃일 때 농도(CA)와 시간에 따른 농도변화량(-dCA/dt)을 그래프로 나타낸 것이다. 이 그래프는 일반적인 1차 반응 속도식을 나타낸 것이다. 농도가 증가할수록 농도변화량이 증가하는 것을 볼 수 있다. 시간에 따른 농도 변화량이 증가하는 모습을 보인다.
figure 5. ln(-dCA/dt) vs ln(CA) 그래프(25℃)
이 그래프는 미분법을 사용하여 자료해석을 위해 나타낸 그래프로 이 그래프의 기울기는 반응차수에 해당된다. 이 그래프는 거의 직선이다. 이론적인 선형추세선과는 약간 차이가 발생하였다.
figure 6. ln(CAo/CA) vs Time 그래프(34℃)
34℃에서 2차 반응으로 가정하여 계산한 식에서 나온 그래프와 비교시 1차 반응가정 그래프는 선형 추세선과는 많은 차이를 보이므로 반응이 정확히 1차가 아님을 알 수 있다.
figure 7. ln(CAo/CA) vs Time 그래프(45℃)
45℃에서 2차 반응으로 가정하여 계산한 식에서 나온 그래프와 비교 시 1차 반응가정 그래프는 선형 추세선과는 많은 차이를 보이므로 반응이 정확히 1차가 아님을 알 수 있다.
3.2. Discussion
이번 실험은 에틸아세테이트와 NaOH가 화학반응을 통해 반응 속도 상수와 반응 차수를 알아보는 실험이었다. 에틸아세테이트와 NaOH의 반응은 반응을 하면 pH와 전도도가 변화하는데 전도도가 변화하는 것을 확인하여 반응의 농도를 계산하고 반응의 진행정도를 실시간으로 확인이 가능 하였다. 반응차수는 온도에 관계없이 거의 일정하게 2정도의 값을 나타내었다. 25℃의 반응차수를 알아보기 위하여 먼저 적분법을 사용하여 알아보면 (CA0/CA) vs t와 1/CA vs t의 그래프 두 개를 그리고, 직선적인 추세선을 그려서 추세선과 가장 가까운 값을 가지는 그래프를 확인해 보았다. (CA0/CA) vs t는 그래프의 형태가 로그함수적인 형태를 띄었고, 1/CA vs t의 그래프는 직선적인 형태를 띄었다. 그 결과 1차 반응을 나타내는 (CA0/CA) vs t보다는 2차 반응을 나타내는 1/CA vs t의 그래프가 직선 추세선과 더 잘 맞아 떨어졌다. 이러한 결과를 보아서 이 반응은 2차 반응이라는 것을 추측할 수 있었다. 34℃의 반응차수도 25℃와 같은 방법으로 데이터를 분석하였을 때 결과도 25℃와 비슷하게 나타났다. 45℃의 반응차수 역시 25℃와 같은 방법으로 데이터를 분석하였고, 결과 역시 비슷한 값이 나오는 것을 알 수 있었다.
2차 반응을 나타내는 추세선과 거의 비슷한 그래프가 나오지만 거의 일치하는 것도 있었지만 그렇지 않은 그래프도 있었다. 그 이유로는 반응기가 온도를 잘 제어하지 못해서 인 것 같다. 반응을 하는 동안에도 온도가 일정하게 유지되는 것이 아니라 조금씩의 변화가 생겼다. 반응이 온도에 민감했다고 한다면 약간의 온도차이로도 큰 오차가 생겼을 것이라고 생각된다. 또한 반응이 완벽히 일어나지 않아 반응차수가 차이가 생겼을 가능성이 있고 세척을 하고 남아있던 증류수가 NaOH의 농도를 묽게 만들어 오차가 생겼을 수도 있다고 생각된다.
4. Conclusion
이 실험은 회분식 반응기를 사용하여 반응이 일어남에 따라 전도도와 pH가 변하는 실험을 통하여 반응 속도 상수와 반응차수를 알아보는 실험이었다. 실험은 0.04M의 NaOH용액을 넣어주고 안정이 되면 에틸아세테이트를 5㎖를 넣어주어 교반하면서 전도도와 pH를 측정하였다. 온도가 25℃, 34℃, 45℃ 일 때 3번에 걸쳐서 실험을 하였다. 온도가 높아질수록 반응이 빨리 끝나서 전도도가 줄어들어 서서히 일정해지는 모습을 보이는 시간이 온도가 높을수록 짧아짐을 알 수 있었다. 반응차수는 온도에 관계없이 거의 일정하게 2정도의 값을 나타내었다. 25℃의 반응차수를 알아보기 위하여 먼저 적분법을 사용하여 알아보면 (CA0/CA) vs t와 1/CA vs t의 그래프 두 개를 그리고, 직선적인 추세선을 그려서 추세선과 가장 가까운 값을 가지는 그래프를 확인해 보았다. (CA0/CA) vs t는 그래프의 형태가 로그함수적인 형태를 띄었고, 1/CA vs t의 그래프는 직선적인 형태를 띄었다. 그 결과 1차 반응을 나타내는 (CA0/CA) vs t보다는 2차 반응을 나타내는 1/CA vs t의 그래프가 직선 추세선과 더 잘 맞아 떨어졌다. 이러한 결과를 보아서 이 반응은 2차 반응이라는 것을 추측할 수 있었다. 34℃의 반응차수도 25℃와 같은 방법으로 데이터를 분석하였을 때 결과도 25℃와 비슷하게 나타났다. 45℃의 반응차수 역시 25℃와 같은 방법으로 데이터를 분석하였고, 결과 역시 비슷한 값이 나오는 것을 알 수 있었다.
2차 반응을 나타내는 추세선과 거의 비슷한 그래프가 나오지만 거의 일치하는 것도 있었지만 그렇지 않은 그래프도 있었다. 그 이유로는 반응기가 온도를 잘 제어하지 못해서 인 것 같다. 반응을 하는 동안에도 온도가 일정하게 유지되는 것이 아니라 올라갔다가 내려갔다가 하면서 조금씩의 변화가 생겼다. 반응이 온도에 민감하다고 한다면 약간의 온도차이로도 큰 오차가 생겼을 것이라고 생각된다. 또한 반응기내에서 반응이 완벽히 일어나지 않아 반응차수가 차이가 생겼을 가능성이 있고, 반응기에 세척을 하고 남아있던 증류수가 NaOH의 농도를 묽게 만들어 오차가 생겼을 수도 있다고 생각된다.
5. Reference
[1] 화학 공학 개론, 1st ed, 동화 기술, 고완석, 김영준, 임계규, 209-219
[2] 화학반응공학, 동화기술, 홍연기외 4명, 82-85
추천자료
 [화학공학실험]산화-환원 적정 실험 프레젠테이션 자료
[화학공학실험]산화-환원 적정 실험 프레젠테이션 자료 [화학공학기초실험] 2. 추출
[화학공학기초실험] 2. 추출 [화학공학기초실험] 3.초산에틸의 비누화 반응
[화학공학기초실험] 3.초산에틸의 비누화 반응 [화학공학실험]액체의 밀도 실험 결과레포트
[화학공학실험]액체의 밀도 실험 결과레포트 [화학실험] 친핵성 치환반응 결과보고서
[화학실험] 친핵성 치환반응 결과보고서  화학적 산소요구량(COD) 측정연혁, 화학적 산소요구량(COD) 실험기구와 시약, 화학적 산소요...
화학적 산소요구량(COD) 측정연혁, 화학적 산소요구량(COD) 실험기구와 시약, 화학적 산소요... [화학공학실험] 혼합조 실험 (예비+결과레포트)
[화학공학실험] 혼합조 실험 (예비+결과레포트) [화학반응실험][화학반응]화학반응 사례1(대사), 화학반응 사례2(색변화), 화학반응 사례3(정...
[화학반응실험][화학반응]화학반응 사례1(대사), 화학반응 사례2(색변화), 화학반응 사례3(정... 화공기사 실기 작업형 행동요령
화공기사 실기 작업형 행동요령 [단위실험] 레이놀즈 실험[Reynolds Number]
[단위실험] 레이놀즈 실험[Reynolds Number] 화학공학 실험 - 열풍온도제어
화학공학 실험 - 열풍온도제어 화학공학 기초 실험 - (결과) 염색 실험
화학공학 기초 실험 - (결과) 염색 실험 [화학실험] 나일론의 제조 : 분자 말단에 아민(-NH2)기와 카르복시(-COOH)기를 갖고 있는 서...
[화학실험] 나일론의 제조 : 분자 말단에 아민(-NH2)기와 카르복시(-COOH)기를 갖고 있는 서... 아세트아닐라이드(Acetanilide) : 아세틸화 반응을 이용하여 여러가지 합성의 중간체로 사용...
아세트아닐라이드(Acetanilide) : 아세틸화 반응을 이용하여 여러가지 합성의 중간체로 사용...

































소개글