목차
1. 실험 목적
2. 실험 이론
2-1. 반응속도와 반응속도상수
2-2. GC이론
3. 실험 장치
4. 실험 방법
5. 실험결과
6. 고찰 및 토의
7. 참고 문헌
2. 실험 이론
2-1. 반응속도와 반응속도상수
2-2. GC이론
3. 실험 장치
4. 실험 방법
5. 실험결과
6. 고찰 및 토의
7. 참고 문헌
본문내용
세 가지 기체의 흐름이다.
4. 실험 방법
실험 준비
GC의 전원을 공급하고 Detector 및 Oven의 온도를 설정하여 안정화 한다.
-4시간 이상 소요됨; Oven 100℃, Injector 200℃, Detector 260℃
실험 1 GC calibration
① 보정 완료된 MFC를 사용하여 전화하지 않은 공급물 CH4, iso - butene를 1:1, 2:1, 1:2 몰비로 혼합한다.
② 일정한 GHSV 조건에서 반응기를 우회하여 GC로 공급 후 주입된 시료의 분석 결과를 사용하여 GC를 검량한다.
실험 2. 활성화 에너지
① 촉매 0.5g을 반응기에 내장한 후 1% iso - butene/balanced 반응 시료를 분당 20 보내서 steady state로 유지한다.
② 반응기의 온도를 30, 50, 70 ,90,110℃ 까지 승온 하면서 각각의 반응 온도에서 정상조건에서의 수율을 측정하기 위하여 반응후의 시료용 gas syringe로 채취하여 FID GC에 10l 씩 주입하여 분석한다.
③ 전환율 및 선택도를 온도의 함수로 도시한다.
④ 반응 활성화 에너지를 도표로부터 계산한다.
실험3. 반응차수
① 촉매 0.5g을 반응기에 내장한 후 보정 완료된 MFC를 사용하여 전화하지 않은 공급물 1% iso-butene/balanced , 100% 공급 시료를 1:1, 2:1, 1:2 몰비로 혼합한다. ② 일정한 GHSV 조건에서 공급물 총량을 분당 20 보내서 steady state 로 유지한다.
③ 반응 후의 생성물을 GC로 공급 후 주입된 시료의 분석 결과(gas chromatogram)를 사용하여 반응차수를 계산한다.
④ 반응기의 온도를 110℃ 까지 유지하면서 정상조건에서의 수율을 측정하기 위하여 반응 후 시료를 gas syringe로 채취하여 FID GC에 10l 씩 주입하여 분석한다.
⑤ 전환율 및 선택도를 온도의 함수로 도시한다.
⑥ 반응 활성화 에너지를 도표로부터 계산한다.
5. 실험결과
1) iso-butene과 methane의 검량곡선
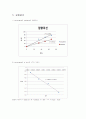
2) iso-butene의 ln Xa VS 1/T의 그래프
활성화 에너지 = 2083.3 X R = 2083.3 X 1.987 = 4.14 kcal / mole
3) iso-butene의 ln ra VS ln Ca의 그래프
기울기 = 1 -> n = 1
이 반응은 1차 반응이다.
절편 = -ln k -> k = 0.091
6. 고찰 및 토의
이 실험은 GC를 통해 iso-butene의 반응차수와 활성화 에너지를 구하는 실험이었다.
우선 검량곡선을 작성하기 위해서 MFC를 사용하여 전화되지 않은 공급기체 methane과 iso-butene을 1:1, 1:2, 2:1 몰비로 혼합한 기체를 순차적으로 일정한 GHSV 조건에서 반응기를 거치지 않고 순수한 혼합가스만을 채취하여 GC를 통해 분석된 결과 값을 토대로 y축을 면적, x축을 농도로 하여 검량곡선을 작성하였다. 3가지 데이터로만은 0점을 통과하지 않아서 (0,0)의 데이터를 추가적으로 입력하여 그래프를 작성, 추세선을 통한 수식을 얻었는데 이로 인해 오차가 발생했을 것이라 생각된다. 또한 이러한 검량곡선을 얻은 이유는 질소기체의 충분한 퍼지가 이루어지지 않아 잔존했던 iso-butene이나 metahne이 분석에 영향을 주었을 것이라 생각된다. 두 번째 실험으로 30℃~110℃까지 20℃씩 승온 시켜 각각의 온도별로 기체시료를 10l을 분석하여 얻은 결과 값을 통해 검량곡선에 대입하여 전화율을 얻을 수 있었는데, y축을 ln Xa x축을 1/T의 그래프를 플롯하여 -2083.3을 얻었다. 이 데이터로 활성화 에너지 즉, E를 구해본 결과 2083.3 X 1.987 = 4.14 Kcal/mole을 얻게 되었다.
전화율은 30℃ ~ 90℃ 순서로 23%, 39.4%, 51%, 74.5%를 얻었는데 온도가 증가함에 따라 반응되는 시료의 양이 증가하는 것을 알 수 있고, 반응속도 또한 증가함을 알 수 있다.
또한 활성에너지 외에 측정 시에 오차의 원인으로 생각 할 수 있는 것이 시료채집 장소와 기기가 있는 장소까지 이동하는 동안에 손실될 수 있는 시료가 있기 때문에 오차가 생긴 것 같다. 세 번째 실험은 온도를 110℃로 일정하게 유지 시키고 촉매 0.5g을 반응기에 내장한 후 보정 완료된 MFC를 사용하여 전화되지 않은 공급기체 1% n-butene/balanced N₂, 100% N₂ 공급 시료를 1:1, 1:2, 2:1 몰비로 혼합한 기체를 순차적으로 일정한 GHSV 조건에서 공급기체의 총유량을 20cm³ / min으로 흘려 정상상태로 유지 시킨 후 시료를 채취하여 GC를 통해 분석한 데이터를 통해 반응 차수를 구하였다. 그래프는 ra= k Ca의 식을 ln ra= ln k + n ln Ca 로 바꾸어서 y축을 ln ra x축을 ln Ca로 그래프를 플롯한 결과로
y = x - 2.398이라는 일차함수를 얻게 되었다 여기서 기울기 = 1 즉, n = 1로 이 반응은 1차 반응이라는 사실을 알 수 있다. 또한 농도가 증가함에 따라 반응속도 또한 증가하는 것을 볼 수 있는데 이것은 “n = 1인 경우 1차 반응으로 속도는 농도에 비례한다.”라는 이론과 잘 부합되는 것을 알 수 있다. 또한 질소를 운반기체로 사용하는 이유는 질소는 다른 가스와 반응을 하지 않고 안정적이며 밀도가 높아서 컬럼에서 피크가 퍼지는 정도를 더 적게하고, 효율을 증가시키기 때문에 질소기체를 운반기체로써 사용을 하는 것이다.
실험을 통해서 GC의 작동법과 원리 등을 배울 수 있었고, 반응공학 수업 때 이론으로만 공부하던 것을 직접 실험을 통해서 구해 좋은 경험이 되었다. 또한 시간적 여유가 많지 않아 좀 더 나은 데이터를 얻지는 못하였지만, 좀 더 숙달되고, 실험의 재현성을 높이면 이 보다 더 이론에 가까운 결과 데이터를 얻을 수 있을 것이라 생각한다.
7. 참고 문헌
화학반응공학 3판/Octave Levenspiel(김상환, 임선기 공역)/사이텍미디어/2000년도/3장
크로마토그래피(GC/HPLC)의 원리/박송자 /KIST생체대사연구센터/2000.1.14/pp.15~20
4. 실험 방법
실험 준비
GC의 전원을 공급하고 Detector 및 Oven의 온도를 설정하여 안정화 한다.
-4시간 이상 소요됨; Oven 100℃, Injector 200℃, Detector 260℃
실험 1 GC calibration
① 보정 완료된 MFC를 사용하여 전화하지 않은 공급물 CH4, iso - butene를 1:1, 2:1, 1:2 몰비로 혼합한다.
② 일정한 GHSV 조건에서 반응기를 우회하여 GC로 공급 후 주입된 시료의 분석 결과를 사용하여 GC를 검량한다.
실험 2. 활성화 에너지
① 촉매 0.5g을 반응기에 내장한 후 1% iso - butene/balanced 반응 시료를 분당 20 보내서 steady state로 유지한다.
② 반응기의 온도를 30, 50, 70 ,90,110℃ 까지 승온 하면서 각각의 반응 온도에서 정상조건에서의 수율을 측정하기 위하여 반응후의 시료용 gas syringe로 채취하여 FID GC에 10l 씩 주입하여 분석한다.
③ 전환율 및 선택도를 온도의 함수로 도시한다.
④ 반응 활성화 에너지를 도표로부터 계산한다.
실험3. 반응차수
① 촉매 0.5g을 반응기에 내장한 후 보정 완료된 MFC를 사용하여 전화하지 않은 공급물 1% iso-butene/balanced , 100% 공급 시료를 1:1, 2:1, 1:2 몰비로 혼합한다. ② 일정한 GHSV 조건에서 공급물 총량을 분당 20 보내서 steady state 로 유지한다.
③ 반응 후의 생성물을 GC로 공급 후 주입된 시료의 분석 결과(gas chromatogram)를 사용하여 반응차수를 계산한다.
④ 반응기의 온도를 110℃ 까지 유지하면서 정상조건에서의 수율을 측정하기 위하여 반응 후 시료를 gas syringe로 채취하여 FID GC에 10l 씩 주입하여 분석한다.
⑤ 전환율 및 선택도를 온도의 함수로 도시한다.
⑥ 반응 활성화 에너지를 도표로부터 계산한다.
5. 실험결과
1) iso-butene과 methane의 검량곡선
2) iso-butene의 ln Xa VS 1/T의 그래프
활성화 에너지 = 2083.3 X R = 2083.3 X 1.987 = 4.14 kcal / mole
3) iso-butene의 ln ra VS ln Ca의 그래프
기울기 = 1 -> n = 1
이 반응은 1차 반응이다.
절편 = -ln k -> k = 0.091
6. 고찰 및 토의
이 실험은 GC를 통해 iso-butene의 반응차수와 활성화 에너지를 구하는 실험이었다.
우선 검량곡선을 작성하기 위해서 MFC를 사용하여 전화되지 않은 공급기체 methane과 iso-butene을 1:1, 1:2, 2:1 몰비로 혼합한 기체를 순차적으로 일정한 GHSV 조건에서 반응기를 거치지 않고 순수한 혼합가스만을 채취하여 GC를 통해 분석된 결과 값을 토대로 y축을 면적, x축을 농도로 하여 검량곡선을 작성하였다. 3가지 데이터로만은 0점을 통과하지 않아서 (0,0)의 데이터를 추가적으로 입력하여 그래프를 작성, 추세선을 통한 수식을 얻었는데 이로 인해 오차가 발생했을 것이라 생각된다. 또한 이러한 검량곡선을 얻은 이유는 질소기체의 충분한 퍼지가 이루어지지 않아 잔존했던 iso-butene이나 metahne이 분석에 영향을 주었을 것이라 생각된다. 두 번째 실험으로 30℃~110℃까지 20℃씩 승온 시켜 각각의 온도별로 기체시료를 10l을 분석하여 얻은 결과 값을 통해 검량곡선에 대입하여 전화율을 얻을 수 있었는데, y축을 ln Xa x축을 1/T의 그래프를 플롯하여 -2083.3을 얻었다. 이 데이터로 활성화 에너지 즉, E를 구해본 결과 2083.3 X 1.987 = 4.14 Kcal/mole을 얻게 되었다.
전화율은 30℃ ~ 90℃ 순서로 23%, 39.4%, 51%, 74.5%를 얻었는데 온도가 증가함에 따라 반응되는 시료의 양이 증가하는 것을 알 수 있고, 반응속도 또한 증가함을 알 수 있다.
또한 활성에너지 외에 측정 시에 오차의 원인으로 생각 할 수 있는 것이 시료채집 장소와 기기가 있는 장소까지 이동하는 동안에 손실될 수 있는 시료가 있기 때문에 오차가 생긴 것 같다. 세 번째 실험은 온도를 110℃로 일정하게 유지 시키고 촉매 0.5g을 반응기에 내장한 후 보정 완료된 MFC를 사용하여 전화되지 않은 공급기체 1% n-butene/balanced N₂, 100% N₂ 공급 시료를 1:1, 1:2, 2:1 몰비로 혼합한 기체를 순차적으로 일정한 GHSV 조건에서 공급기체의 총유량을 20cm³ / min으로 흘려 정상상태로 유지 시킨 후 시료를 채취하여 GC를 통해 분석한 데이터를 통해 반응 차수를 구하였다. 그래프는 ra= k Ca의 식을 ln ra= ln k + n ln Ca 로 바꾸어서 y축을 ln ra x축을 ln Ca로 그래프를 플롯한 결과로
y = x - 2.398이라는 일차함수를 얻게 되었다 여기서 기울기 = 1 즉, n = 1로 이 반응은 1차 반응이라는 사실을 알 수 있다. 또한 농도가 증가함에 따라 반응속도 또한 증가하는 것을 볼 수 있는데 이것은 “n = 1인 경우 1차 반응으로 속도는 농도에 비례한다.”라는 이론과 잘 부합되는 것을 알 수 있다. 또한 질소를 운반기체로 사용하는 이유는 질소는 다른 가스와 반응을 하지 않고 안정적이며 밀도가 높아서 컬럼에서 피크가 퍼지는 정도를 더 적게하고, 효율을 증가시키기 때문에 질소기체를 운반기체로써 사용을 하는 것이다.
실험을 통해서 GC의 작동법과 원리 등을 배울 수 있었고, 반응공학 수업 때 이론으로만 공부하던 것을 직접 실험을 통해서 구해 좋은 경험이 되었다. 또한 시간적 여유가 많지 않아 좀 더 나은 데이터를 얻지는 못하였지만, 좀 더 숙달되고, 실험의 재현성을 높이면 이 보다 더 이론에 가까운 결과 데이터를 얻을 수 있을 것이라 생각한다.
7. 참고 문헌
화학반응공학 3판/Octave Levenspiel(김상환, 임선기 공역)/사이텍미디어/2000년도/3장
크로마토그래피(GC/HPLC)의 원리/박송자 /KIST생체대사연구센터/2000.1.14/pp.15~20
키워드
추천자료
 환경화학 실험 예비레포트(pH, acidity, alkalinity, buffer solution)
환경화학 실험 예비레포트(pH, acidity, alkalinity, buffer solution) 결과레포트〃컴퓨터화상실험(단조화운동)
결과레포트〃컴퓨터화상실험(단조화운동) (식품화학실험보고서)GC(가스크로마토그래피에 의한 지질의 분리)
(식품화학실험보고서)GC(가스크로마토그래피에 의한 지질의 분리) 줄의 진동 레포트 - 일반물리학실험
줄의 진동 레포트 - 일반물리학실험 단순조화운동 레포트 - 일반물리학실험
단순조화운동 레포트 - 일반물리학실험 [실험 결과레포트] RLC 직류회로
[실험 결과레포트] RLC 직류회로 마조니아관을 이용한 조지방 정량 실험 결과레포트 입니다.
마조니아관을 이용한 조지방 정량 실험 결과레포트 입니다. 비틀림 실험 (결과레포트)
비틀림 실험 (결과레포트) 유리기구의 불확실성 결과레포트 : 실험에서 사용되는 유리 기구의 용도를 이해하고 사용법을...
유리기구의 불확실성 결과레포트 : 실험에서 사용되는 유리 기구의 용도를 이해하고 사용법을... 산화적정oxidimetry 과망간산법 실험 레포트
산화적정oxidimetry 과망간산법 실험 레포트 COD 측정 실험 예비레포트
COD 측정 실험 예비레포트 일반화학실험 재결정 레포트
일반화학실험 재결정 레포트 물리실험 결과 레포트 보고서 - 구심력과 원운동 A+ 연세대
물리실험 결과 레포트 보고서 - 구심력과 원운동 A+ 연세대 일반화학실험-기체의 몰질량 A+레포트
일반화학실험-기체의 몰질량 A+레포트
































소개글