본문내용
M, 0.0125M, 0.00625M, 0.003125M 각각 125mL씩
0.05M - CH3COOH 0.722mL을 피펫으로 뽑아내어 250mL 메스플라스크에 넣고 증류수로 녹여 만든다.
0.025M CH3COOH 조제 - 0.025M CH3COOH 100mL를 조제하기 위하여 0.02M CH3COOH 용액을 50mL 채취하여 증류수 50mL를 채워 묽힌다.
x = 50mL
0.0125M, 0.00625M, 0.003125M, 0.0015625M 용액 또한 위의 방법을 계속 반복하여 만들어낸다.
③ 만든 용액을 각각 20mL씩 비커에 옮겨 담고 전도도를 측정하여 기록한다.
④ 식을 이용하여 비전도도와 당량전도도를 계산하여 데이터를 얻는다.
『실험결과』
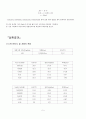
(1) 전기전도도 및 저항의 측정
증류수의 전도도(mS/m)
저항(Ωm)
온도(℃)
4.01
0.244KΩm
21.3
NaCl 농도(M)
온도(℃)
전도도(mS/m)
저항(Ωm)
0.00125
20.3
14.93
67.0
0.0025
20.1
25.4
39.6
0.005
20.0
56.7
17.68
0.01
19.9
111.4
8.97
0.02
20.1
218.0
4.62
NaOH 농도(M)
온도(℃)
전도도(mS/m)
저항(Ωm)
0.003125
19.8
8.84
113.2
0.00625
19.8
16.12
62.4
0.0125
20.1
75.4
13.28
0.025
19.9
151.7
6.60
0.05
20
473
2.11
CH3COOH 농도(M)
온도(℃)
전도도(mS/m)
저항(Ωm)
0.003125
19.0
8.93
111.7
0.00625
19.7
12.99
77.1
0.0125
19.7
17.91
55.9
0.025
19.9
25.4
39.4
0.05
19.9
34.9
28.7
(2) 비전도도 및 당량 전도도 계산
① 용기 상수 계산
② 비전도도와 당량 전도도 계산
NaCl 농도(M)
비전도도(mS/m2)
당량 전도도(103 S/m2M)
0.00125
1493
1194.4
0.0025
2540
1016
0.005
5670
1134
0.01
11140
1114
0.02
21800
1090
NaOH 농도(M)
비전도도(mS/m2)
당량 전도도(103 S/m2M)
0.003125
884
282.88
0.00625
1612
257.92
0.0125
7540
603.2
0.025
15170
606.8
0.05
47300
946
CH3COOH 농도(M)
비전도도(mS/m2)
당량 전도도(103 S/m2M)
0.003125
893
285.76
0.00625
1299
207.84
0.0125
1791
143.28
0.025
2540
101.6
0.05
3490
69.8
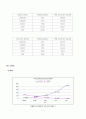
(3) 그래프
NaCl
〔 NaCl 농도에 따른 전도도와 저항도 〕
〔 NaCl 농도제곱근에 따른 비전도도 〕
〔 NaCl 농도제곱근에 따른 당량전도도 〕
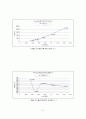
NaOH
〔 NaOH 농도에 따른 전도도와 저항도 〕
〔 NaOH 농도제곱근에 따른 비전도도 〕
〔 NaOH 농도제곱근에 따른 당량전도도 〕
CH3COOH
〔 CH3COOH 농도에 따른 전도도와 저항도 〕
〔 CH3COOH 농도제곱근에 따른 비전도도 〕
〔 CH3COOH농도제곱근에 따른 당량전도도 〕
『논의 및 고찰』
교수님의 이론을 듣고 실험을 시작하기에 앞서 0.02M의 농도로 용액을 만들고 묽혀서 농도를 낮춰 나가는데의 준비과정이 길었다. 그 이유로 실험이 좀 길어지긴 했지만 결론적으로 보면 그렇게 복잡한 실험은 아니었다고 보여진다. NaCl과 NaOH의 경우 농도가 진해짐에 따라서 전도도가 정확하진 않더라고 어느 정도 일정한 폭으로 높아지고, 저항이 일정한 폭으로 낮아지는 것을 관찰할 수 있었다. 그러나 CH3COOH 의 경우 농도가 진해짐에 따라서 전도도와 저항이 일정한 폭으로 증가 혹은 감소를 볼 수가 없었다. 오차의 탓으로 돌려야 할지 실험을 잘못했는지 아니면 농도에 따른 비커의 순서가 바뀌어서 전도도를 잘못 측정했는지 여러 가지 실험오차를 생각해보았으나 실험은 제대로 한 것 같았다. 결국 교수님께 조언을 구한 결과 NaCl과 NaOH같은 강산, 강염기, 중성은 해리되는 정도가 많기 때문에 확실히 전도성을 띄지만 CH3COOH 같은 경우 약산이므로 해리되는 정도가 약하기 때문에 어느 것은 많이 녹고, 어느 것은 적게 녹을 수도 있고 결국 오차가 생길 수 있다는 결론을 내릴 수 있었다. 이론적으로 비전도도는 용액이 묽어짐에 따라서 감소하며 마침내 순수한 용매의 비전도도에 이르게 된다는 것을 책에서 보았는데 우리 실험도 일정하진 않았지만 비전도도는 용액이 묽어짐에 따라서 감소하는 것을 관찰하였다. 이어서 당량전도도는 묽힘에 따라서 증가하는데, 이것은 약전해질의 경우에는 해리가 늘어나기 때문이고 모든 경우에 있어서 이온간 인력이 감소하고 전기 이동 효과가 감소하기 때문이다. 역시 우리 실험도 용액의 농도가 묽어짐에 따라 약간의 오차가 있긴 했지만 당량전도도가 증가하였다. 하지만 NaOH의 경우 용액의 농도가 묽어짐에 따라 당량전도도가 증가함을 보였다. 당량전도도는 비전도도에 1000을 곱하고 그 값을 농도로 나눈 값인데 결국 비전도도에 의해서만 영향을 띌 수가 있다. 즉, 나의 생각으로 농도도 일정하고 결국 비전도도의 값이 일정 폭으로 변하였다면 당량전도도 또한 점차 증가 혹은 감소로 나와야 한다고 생각했었다. 순수 용액에 이 물질이 들어갔거나 혹은 전기전도도계의 측정부분을 정확히 다른 농도로 맞춰주지 못하였기에 오차가 생겼다고 보았다. 우리 실험수준이 미비하기도 하고, 피펫의 사용법부터 눈금읽기 까지 오차의 가능성을 많이 줄이지 못하기 때문에 약간의 오차는 발생할 수 있다고 생각하지만 앞으로의 실험에서 했던 실수를 반복하지 않고 좀 더 신중한 실험이 이루어진다면 괜찮은 값을 얻을 수 있다고 본다.
『참고문헌』
물리화학 RAYMOND CHANG 형설출판사
물리화학 제3판 CASTELLAN 희중당
물리화학 이재원 녹문당
물리화학실험대한화학회청문당1999
물리화학실험최재시 외 2명형설출판사1983
물리화학실험이익춘 외 2명탐구당1992
물리화학실험김성규 외 22명대한화학회1999
0.05M - CH3COOH 0.722mL을 피펫으로 뽑아내어 250mL 메스플라스크에 넣고 증류수로 녹여 만든다.
0.025M CH3COOH 조제 - 0.025M CH3COOH 100mL를 조제하기 위하여 0.02M CH3COOH 용액을 50mL 채취하여 증류수 50mL를 채워 묽힌다.
x = 50mL
0.0125M, 0.00625M, 0.003125M, 0.0015625M 용액 또한 위의 방법을 계속 반복하여 만들어낸다.
③ 만든 용액을 각각 20mL씩 비커에 옮겨 담고 전도도를 측정하여 기록한다.
④ 식을 이용하여 비전도도와 당량전도도를 계산하여 데이터를 얻는다.
『실험결과』
(1) 전기전도도 및 저항의 측정
증류수의 전도도(mS/m)
저항(Ωm)
온도(℃)
4.01
0.244KΩm
21.3
NaCl 농도(M)
온도(℃)
전도도(mS/m)
저항(Ωm)
0.00125
20.3
14.93
67.0
0.0025
20.1
25.4
39.6
0.005
20.0
56.7
17.68
0.01
19.9
111.4
8.97
0.02
20.1
218.0
4.62
NaOH 농도(M)
온도(℃)
전도도(mS/m)
저항(Ωm)
0.003125
19.8
8.84
113.2
0.00625
19.8
16.12
62.4
0.0125
20.1
75.4
13.28
0.025
19.9
151.7
6.60
0.05
20
473
2.11
CH3COOH 농도(M)
온도(℃)
전도도(mS/m)
저항(Ωm)
0.003125
19.0
8.93
111.7
0.00625
19.7
12.99
77.1
0.0125
19.7
17.91
55.9
0.025
19.9
25.4
39.4
0.05
19.9
34.9
28.7
(2) 비전도도 및 당량 전도도 계산
① 용기 상수 계산
② 비전도도와 당량 전도도 계산
NaCl 농도(M)
비전도도(mS/m2)
당량 전도도(103 S/m2M)
0.00125
1493
1194.4
0.0025
2540
1016
0.005
5670
1134
0.01
11140
1114
0.02
21800
1090
NaOH 농도(M)
비전도도(mS/m2)
당량 전도도(103 S/m2M)
0.003125
884
282.88
0.00625
1612
257.92
0.0125
7540
603.2
0.025
15170
606.8
0.05
47300
946
CH3COOH 농도(M)
비전도도(mS/m2)
당량 전도도(103 S/m2M)
0.003125
893
285.76
0.00625
1299
207.84
0.0125
1791
143.28
0.025
2540
101.6
0.05
3490
69.8
(3) 그래프
NaCl
〔 NaCl 농도에 따른 전도도와 저항도 〕
〔 NaCl 농도제곱근에 따른 비전도도 〕
〔 NaCl 농도제곱근에 따른 당량전도도 〕
NaOH
〔 NaOH 농도에 따른 전도도와 저항도 〕
〔 NaOH 농도제곱근에 따른 비전도도 〕
〔 NaOH 농도제곱근에 따른 당량전도도 〕
CH3COOH
〔 CH3COOH 농도에 따른 전도도와 저항도 〕
〔 CH3COOH 농도제곱근에 따른 비전도도 〕
〔 CH3COOH농도제곱근에 따른 당량전도도 〕
『논의 및 고찰』
교수님의 이론을 듣고 실험을 시작하기에 앞서 0.02M의 농도로 용액을 만들고 묽혀서 농도를 낮춰 나가는데의 준비과정이 길었다. 그 이유로 실험이 좀 길어지긴 했지만 결론적으로 보면 그렇게 복잡한 실험은 아니었다고 보여진다. NaCl과 NaOH의 경우 농도가 진해짐에 따라서 전도도가 정확하진 않더라고 어느 정도 일정한 폭으로 높아지고, 저항이 일정한 폭으로 낮아지는 것을 관찰할 수 있었다. 그러나 CH3COOH 의 경우 농도가 진해짐에 따라서 전도도와 저항이 일정한 폭으로 증가 혹은 감소를 볼 수가 없었다. 오차의 탓으로 돌려야 할지 실험을 잘못했는지 아니면 농도에 따른 비커의 순서가 바뀌어서 전도도를 잘못 측정했는지 여러 가지 실험오차를 생각해보았으나 실험은 제대로 한 것 같았다. 결국 교수님께 조언을 구한 결과 NaCl과 NaOH같은 강산, 강염기, 중성은 해리되는 정도가 많기 때문에 확실히 전도성을 띄지만 CH3COOH 같은 경우 약산이므로 해리되는 정도가 약하기 때문에 어느 것은 많이 녹고, 어느 것은 적게 녹을 수도 있고 결국 오차가 생길 수 있다는 결론을 내릴 수 있었다. 이론적으로 비전도도는 용액이 묽어짐에 따라서 감소하며 마침내 순수한 용매의 비전도도에 이르게 된다는 것을 책에서 보았는데 우리 실험도 일정하진 않았지만 비전도도는 용액이 묽어짐에 따라서 감소하는 것을 관찰하였다. 이어서 당량전도도는 묽힘에 따라서 증가하는데, 이것은 약전해질의 경우에는 해리가 늘어나기 때문이고 모든 경우에 있어서 이온간 인력이 감소하고 전기 이동 효과가 감소하기 때문이다. 역시 우리 실험도 용액의 농도가 묽어짐에 따라 약간의 오차가 있긴 했지만 당량전도도가 증가하였다. 하지만 NaOH의 경우 용액의 농도가 묽어짐에 따라 당량전도도가 증가함을 보였다. 당량전도도는 비전도도에 1000을 곱하고 그 값을 농도로 나눈 값인데 결국 비전도도에 의해서만 영향을 띌 수가 있다. 즉, 나의 생각으로 농도도 일정하고 결국 비전도도의 값이 일정 폭으로 변하였다면 당량전도도 또한 점차 증가 혹은 감소로 나와야 한다고 생각했었다. 순수 용액에 이 물질이 들어갔거나 혹은 전기전도도계의 측정부분을 정확히 다른 농도로 맞춰주지 못하였기에 오차가 생겼다고 보았다. 우리 실험수준이 미비하기도 하고, 피펫의 사용법부터 눈금읽기 까지 오차의 가능성을 많이 줄이지 못하기 때문에 약간의 오차는 발생할 수 있다고 생각하지만 앞으로의 실험에서 했던 실수를 반복하지 않고 좀 더 신중한 실험이 이루어진다면 괜찮은 값을 얻을 수 있다고 본다.
『참고문헌』
물리화학 RAYMOND CHANG 형설출판사
물리화학 제3판 CASTELLAN 희중당
물리화학 이재원 녹문당
물리화학실험대한화학회청문당1999
물리화학실험최재시 외 2명형설출판사1983
물리화학실험이익춘 외 2명탐구당1992
물리화학실험김성규 외 22명대한화학회1999
키워드
추천자료
 전기 아연 도금공장의 Zn-Ni 도금액 청정화 기술
전기 아연 도금공장의 Zn-Ni 도금액 청정화 기술 전기구리도금
전기구리도금 열전도 실험 예비 보고서
열전도 실험 예비 보고서 <화공기초실험>중화열측정<결과>
<화공기초실험>중화열측정<결과> <실험> 완충액 준비, pH측정, 아미노산의 pI 및 pKa 측정
<실험> 완충액 준비, pH측정, 아미노산의 pI 및 pKa 측정 전도성 고분자의 원리와 활용(The Principle and Application of Conducting Polymer)
전도성 고분자의 원리와 활용(The Principle and Application of Conducting Polymer) 용존산소측정방법
용존산소측정방법 초전도체의 특징과 종류 개발상태
초전도체의 특징과 종류 개발상태 전기생리학검사
전기생리학검사 전기와_문화생활_레포트
전기와_문화생활_레포트 [섬유공학과] (결과) 전기방사 - 전기방사의 원리와 과정을 이해하고, 나노섬유의 제조방법과...
[섬유공학과] (결과) 전기방사 - 전기방사의 원리와 과정을 이해하고, 나노섬유의 제조방법과... [일반화학실험] (예비와 결과) 전기분해와 도금 - 전기 에너지를 이용해서 일어나는 화학 반...
[일반화학실험] (예비와 결과) 전기분해와 도금 - 전기 에너지를 이용해서 일어나는 화학 반... 열전도현상을 이용한 사례
열전도현상을 이용한 사례 등전위선측정실험
등전위선측정실험





























소개글