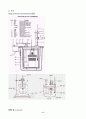
본문내용
서 관 연결
③주 밸브 천천히 조금씩 연다.
④압력 밸브를 25 atm으로 맞춘다.
⑤실험 후 주 밸브와 압력 밸브를 잠근다.
⑥나머지 밸브 열고 bomb 위 부분을 열어준다.(압력 차이에 의해)
8. 데이터 분석
꼭 알아야 할 식
DELTA H= {C DELTA T - e n - f} over m
,
C= {H m+e n+f} over T
C: bomb의 열용량 (cal/ C)
H: benzoic acid의 연소열 (6057cal/g)
m: benzoic acid의 무게 (g)
n: 연소된 Nickel-chrominum Fuse의 질량
e: Nickel-chrominum Fuse (1400cal/g)
f: 질산 생성열 (0.1N
NaOH
적정시 1ml 당 0.138cal/g)
=> 표정된
NaOH
몰랄농도 소비된
NaOH
부피 = 질산의 몰수
T (온도변화) = 온도 보정
시료의 연료 퓨즈선이 연소 및 질산의 생성물들이 복합체요인에 의해 생긴 온도 상승량
T = T_c - T_a - r1(b-a) - r2(c-b)
: 온도 변화
a: 점화시간
b: 총 온도 변화의 60%되는 점의 시간
c: 온도 상승후 온도 변화율이 일정해지는 곳의 시간
T_a
: 점화할 때의 온도
T_c
: 시간 c 에서의 온도
r1: 점화 후 2분동안 온도가 올라간 비율( /min)
r2: B점 이후 2분동안 온도가 올라간 비율( /min)
의 연소
시간
0
15
30
45
60
75
90
105
120
135
150
165
180
195
210
225
240
255
270
온도
16.8
16.8
16.9
17.2
17.7
18.2
18.6
18.9
19.1
19.3
19.4
19.5
19.5
19.6
19.6
19.7
-
-
-
시간
0
15
30
45
60
75
90
105
120
135
150
165
180
195
210
225
240
255
270
온도
17.2
17.2
17.3
17.7
18.2
18.6
19.0
19.2
19.4
19.6
19.7
19.8
19.9
20.0
20.0
20.0
20.1
-
-
온도 보정 T값을 구해보면
T= { T}_{c } - { T}_{a } -r1(b-a)-r2(c-b)
a. 점화시간 : 0s
b. 총 온도 변화의 60%되는 점의 시간 : 90s(1.50min)
c. 온도 상승후 온도 변화율이 일정해지는 곳의 시작시간 : 1회=225s(3.75min), 2회 240s(4.00min)
{ T}_{c } - { T}_{a }
. 2.9
r1. 점화한 후 2분동안 온도가 올라간 비율 : 1회 1.15 /min, 2회 1.10 /min
r2. b점 이후 2분동안 온도가 올라간 비율 : 0.50 /min
위 데이터를 가지고 T를 구해본 결과 1회 0.05, 2회 0값을 얻어 온도 보정값에서 보정식이 잘못된 것인지 아니면, 우리가 실험을 잘못한 건지 매우 애매한 값을 얻었다. 아무리 보정값이라 해도 실험값인 2.9 에서 그렇게 차이가 없어야 되는데 0.05, 0이라는 값은 그렇게 믿음이 가는 수치가 아니다. 실제 그 값의 평균값인 0.025를 가지고 bomb 열량계의 열용량을 구해보면 엄청나게 큰 값을 얻는다. 따라서 우리는 니크롬선 및 질산 생성열 값을 계산해본 결과 14.4cal/g정도로 benzoic -acid의 연소열에 비해 0.2% 정도 밖에 안되는 작은 값이므로 굳이 보정식을 쓰지 않고, 온도 변화값을 이용해 열용량을 구했다.
C = 2098.42(cal/ )
이제 이 값을 토대로 해서 나프탈렌의 연소열을 구해보면
<나프탈렌>의 연소
시간
0
15
30
45
60
75
90
105
120
135
150
165
180
195
210
225
240
255
270
온도
16.8
16.9
17.0
17.5
18.3
19.0
19.6
20.0
20.4
20.6
20.8
20.9
21.1
21.1
21.2
21.3
21.3
21.3
21.4
시간
0
15
30
45
60
75
90
105
120
135
150
165
180
195
210
225
240
255
270
온도
17.0
17.2
17.8
18.5
19.2
19.8
20.3
20.6
20.9
21.1
21.2
21.3
21.4
21.4
21.5
21.5
21.5
21.6
-
H= { C TIMES T-e TIMES n-f} over {m }
를 이용해 구하면
C : 2098.42(cal/ )
T : 1,2회 모두 4.6
e : fuse(1400cal/g)
n : 연소된 fuse 질량 1,2회 0.02g
f : 질산 생성열 (0.1N NaOH 적정시 1ml당 0.138cal/g) 3ml 적정
위 값을 이용해 나프탈렌의 연소열을 구해본 결과
H = 9624.32(cal/g)
이론치를 찾아보니 5,157kJ/mol이었다. 위 값을 가지고 환산해보면.
{ 9624.32cal} over {1g(나프탈렌) } TIMES { 4.2J} over {1cal } TIMES { 128.2g(나프탈렌)} over {1mol(나프탈렌) } =
5.182kJ/mol
9. 토의 및 감상
이번 실험은 생각보다 그렇게 어려운 실험도 아니었고, 시간이 오래 걸리는 실험도 아니었다. 단지 좀 찝찝한 게 있다면 온도 보정식이다. 온도 보정식을 사용한 T값이 너무나 턱도 없는 값이라서 우리는 보정치를 사용하지 않고 실험값 그대로를 가지고 연소열을 구했다. 그런데 놀랍게도 실제 그 오차는 겨우 0.5%밖에 되지 않았다. 실험할 때 완전연소만 시킨다면 그렇게 어려운 실험이 아닐꺼라고 앞 조한테 얘기를 들었는데, 결과는 대단히 만족스러웠다. 온도 보정값이 왜 그렇게 나왔는지는 아직도 의문이다.
bomb 열량계 첨엔 산소가스 주입 때문에 어떻게 사용하나 했는데, 겉보기에 통만 컸지 실제 열량계는 조그만 사이즈에 산소가스 채우는 것도 별로 어렵지 않았다. 가스는 15∼20기압 정도 넣으니까 충분히 연소가 잘 이루어졌다. 실험방법처럼 그렇게 많이 넣을 필요는 없는 듯. 괜히 겁먹고 그럴 필요가 없을거 같다.. 무엇보다 이번 실험은 이론치에 가까운 결과값을 얻게 되서 매우 만족스럽다.
③주 밸브 천천히 조금씩 연다.
④압력 밸브를 25 atm으로 맞춘다.
⑤실험 후 주 밸브와 압력 밸브를 잠근다.
⑥나머지 밸브 열고 bomb 위 부분을 열어준다.(압력 차이에 의해)
8. 데이터 분석
꼭 알아야 할 식
DELTA H= {C DELTA T - e n - f} over m
,
C= {H m+e n+f} over T
C: bomb의 열용량 (cal/ C)
H: benzoic acid의 연소열 (6057cal/g)
m: benzoic acid의 무게 (g)
n: 연소된 Nickel-chrominum Fuse의 질량
e: Nickel-chrominum Fuse (1400cal/g)
f: 질산 생성열 (0.1N
NaOH
적정시 1ml 당 0.138cal/g)
=> 표정된
NaOH
몰랄농도 소비된
NaOH
부피 = 질산의 몰수
T (온도변화) = 온도 보정
시료의 연료 퓨즈선이 연소 및 질산의 생성물들이 복합체요인에 의해 생긴 온도 상승량
T = T_c - T_a - r1(b-a) - r2(c-b)
: 온도 변화
a: 점화시간
b: 총 온도 변화의 60%되는 점의 시간
c: 온도 상승후 온도 변화율이 일정해지는 곳의 시간
T_a
: 점화할 때의 온도
T_c
: 시간 c 에서의 온도
r1: 점화 후 2분동안 온도가 올라간 비율( /min)
r2: B점 이후 2분동안 온도가 올라간 비율( /min)
시간
0
15
30
45
60
75
90
105
120
135
150
165
180
195
210
225
240
255
270
온도
16.8
16.8
16.9
17.2
17.7
18.2
18.6
18.9
19.1
19.3
19.4
19.5
19.5
19.6
19.6
19.7
-
-
-
시간
0
15
30
45
60
75
90
105
120
135
150
165
180
195
210
225
240
255
270
온도
17.2
17.2
17.3
17.7
18.2
18.6
19.0
19.2
19.4
19.6
19.7
19.8
19.9
20.0
20.0
20.0
20.1
-
-
온도 보정 T값을 구해보면
T= { T}_{c } - { T}_{a } -r1(b-a)-r2(c-b)
a. 점화시간 : 0s
b. 총 온도 변화의 60%되는 점의 시간 : 90s(1.50min)
c. 온도 상승후 온도 변화율이 일정해지는 곳의 시작시간 : 1회=225s(3.75min), 2회 240s(4.00min)
{ T}_{c } - { T}_{a }
. 2.9
r1. 점화한 후 2분동안 온도가 올라간 비율 : 1회 1.15 /min, 2회 1.10 /min
r2. b점 이후 2분동안 온도가 올라간 비율 : 0.50 /min
위 데이터를 가지고 T를 구해본 결과 1회 0.05, 2회 0값을 얻어 온도 보정값에서 보정식이 잘못된 것인지 아니면, 우리가 실험을 잘못한 건지 매우 애매한 값을 얻었다. 아무리 보정값이라 해도 실험값인 2.9 에서 그렇게 차이가 없어야 되는데 0.05, 0이라는 값은 그렇게 믿음이 가는 수치가 아니다. 실제 그 값의 평균값인 0.025를 가지고 bomb 열량계의 열용량을 구해보면 엄청나게 큰 값을 얻는다. 따라서 우리는 니크롬선 및 질산 생성열 값을 계산해본 결과 14.4cal/g정도로 benzoic -acid의 연소열에 비해 0.2% 정도 밖에 안되는 작은 값이므로 굳이 보정식을 쓰지 않고, 온도 변화값을 이용해 열용량을 구했다.
C = 2098.42(cal/ )
이제 이 값을 토대로 해서 나프탈렌의 연소열을 구해보면
<나프탈렌>의 연소
시간
0
15
30
45
60
75
90
105
120
135
150
165
180
195
210
225
240
255
270
온도
16.8
16.9
17.0
17.5
18.3
19.0
19.6
20.0
20.4
20.6
20.8
20.9
21.1
21.1
21.2
21.3
21.3
21.3
21.4
시간
0
15
30
45
60
75
90
105
120
135
150
165
180
195
210
225
240
255
270
온도
17.0
17.2
17.8
18.5
19.2
19.8
20.3
20.6
20.9
21.1
21.2
21.3
21.4
21.4
21.5
21.5
21.5
21.6
-
H= { C TIMES T-e TIMES n-f} over {m }
를 이용해 구하면
C : 2098.42(cal/ )
T : 1,2회 모두 4.6
e : fuse(1400cal/g)
n : 연소된 fuse 질량 1,2회 0.02g
f : 질산 생성열 (0.1N NaOH 적정시 1ml당 0.138cal/g) 3ml 적정
위 값을 이용해 나프탈렌의 연소열을 구해본 결과
H = 9624.32(cal/g)
이론치를 찾아보니 5,157kJ/mol이었다. 위 값을 가지고 환산해보면.
{ 9624.32cal} over {1g(나프탈렌) } TIMES { 4.2J} over {1cal } TIMES { 128.2g(나프탈렌)} over {1mol(나프탈렌) } =
5.182kJ/mol
9. 토의 및 감상
이번 실험은 생각보다 그렇게 어려운 실험도 아니었고, 시간이 오래 걸리는 실험도 아니었다. 단지 좀 찝찝한 게 있다면 온도 보정식이다. 온도 보정식을 사용한 T값이 너무나 턱도 없는 값이라서 우리는 보정치를 사용하지 않고 실험값 그대로를 가지고 연소열을 구했다. 그런데 놀랍게도 실제 그 오차는 겨우 0.5%밖에 되지 않았다. 실험할 때 완전연소만 시킨다면 그렇게 어려운 실험이 아닐꺼라고 앞 조한테 얘기를 들었는데, 결과는 대단히 만족스러웠다. 온도 보정값이 왜 그렇게 나왔는지는 아직도 의문이다.
bomb 열량계 첨엔 산소가스 주입 때문에 어떻게 사용하나 했는데, 겉보기에 통만 컸지 실제 열량계는 조그만 사이즈에 산소가스 채우는 것도 별로 어렵지 않았다. 가스는 15∼20기압 정도 넣으니까 충분히 연소가 잘 이루어졌다. 실험방법처럼 그렇게 많이 넣을 필요는 없는 듯. 괜히 겁먹고 그럴 필요가 없을거 같다.. 무엇보다 이번 실험은 이론치에 가까운 결과값을 얻게 되서 매우 만족스럽다.