
-
1
-
2
-
3
-
4
-
5
-
6
-
7
-
8
-
9
-
10
-
11
-
12
-
13
-
14
-
15
-
16
-
17
-
18
-
19
-
20
-
21
-
22
-
23
-
24
-
25
-
26
-
27
-
28
-
29
-
30
-
31
-
32
-
33
-
34
-
35
-
36
-
37
-
38
-
39


본문내용
은형
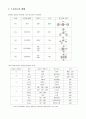
H2O
5
AX5
90 , 120 , 180
삼각쌍뿔형
PF5
AX4E
90 , 120 , 180
시소형
SF4
AX3E2
90 , 180
T-형
ClF3
AX2E3
180
선형
XeF2
6
AX6
90 , 180
정팔면체
SF6
AX5E
90 , 180
사각피라미드
ClF5
AX4E2
90 , 180
평면사각형
XeF4
* 위의 분자들에서 관측된 결합각은 이상적인 결합각보다 약간 작다.
7. 3 분자의 극성
극성 : 전자의 비대칭적인 분포에 의하여 화학결합 또는 분자가 양극 또는 음극을 갖게 되는 것
쌍극자(dipole)라 부른다.
비극성 : 전자의 대칭적인 분포에 의하여 화학결합 또는 분자에 양극과 음극이 없다.
만일 한 분자가 세 개 이상의 원자로 구성되어 있다면
BeF2는 두 개의 Be-F 극성결합을 갖고 있지만 쌍극자가 놓여 있으므로 상쇄되어 극성을 잃는다.
산소가 수소보다 전기음성도가 더 크기 때문에 O-H 결합은 극성이며 산소원자 주위에서 전자밀도가
가장 높게 된다.
사염화탄소(CCl4)는 BeF2와 같이 극성결합을 가짐에도 불구하고 분자가 비극성을 갖는 예이다.
네 개의 결합이 탄소를 주위로 대칭적으로 놓여서 서로 상쇄되어 비극성이 된다.
7. 4 원자궤도 함수 ; 혼성
혼성궤도함수 : 2s의 궤도함수가 2p의 궤도함수와 혼성하여 새로운 2개의 sp혼성궤도함수를 형성
2s ( ) + 2p ( )( )( ) sp ( ) ( )( )( )
혼성궤도함수와 기하구조
전자쌍의 수
원자 궤도함수
혼성궤도함수
오비탈구조
보기
2
s, p
sp
선형
BeF2, CO2
3
s, 2개의 p
sp2
정삼각형
BF3, SO3
4
s, 3개의 p
sp3
사면체
CH4, NH3, H2O
5
s, 3개의 p, d
sp3d
삼각쌍뿔형
PCl5, SF4, ClF3
6
s, 3개의 p, 2개의 d
sp3d2
팔면체
SF6, ClF5, XeF4
1s
2s
2p
3s
3p
3d
BeF에서 Be원자
( )
( )
( )( )( )
BF3에서 B원자
( )
( )
( )( )( )
CH4에서 C원자
( )
( )
( )( )( )
PCl5에서 P원자
( )
( )
( )( )( )
( )
( )( )( )
( )( )( )( )( )
SF6에서 S원자
( )
( )
( )( )( )
( )
( )( )( )
( )( )( )( )( )
다중결합
이중결합이나 삼중결합에 추가되어 있는 전자쌍이 분자의 기하학적 구조에 큰 영향을 주지 않는다.
다중결합에 있는 추가된 전자쌍은 혼성궤도함수에 위치하지 않는다.
시그마결합과 파이결합
모든 단일결합은 시그마( )결합이다.
다중결합에서 한 개의 전자쌍은 시그마( )결합이고, 나머지는 파이( )결합이다.
제 8장 열화학
8. 1 열흐름의 원리
계 (system) : 우리가 관심의 대상으로 생각하는 우주의 일부분
주위 (surrounding) : 계와 에너지를 교환하며 계를 제외한 우주의 나머지 부분
열흐름의 방향과 부호
흡열과정 (q>0) : 열은 주위로부터 반응계로 흐른다.
열이 주위에서 계로 흘러들어갈 경우 q는 +이다.
발열과정 (q<0) : 열은 반응계로부터 주위로 흐른다.
열이 계에서 주위로 흘러나갈 경우 q는 -이다.
열흐름의 크기
q = C(열용량) t = m c(비열) t
열용량 : 계의 온도를 1 상승시키기 위하여 필요한 열량 [J/ ]
비열 : 순수한 물질 1g의 온도를 1 상승시키는데 필요한 열량 [J/g· ]
1cal = 4.184J
8. 2 열흐름의 측정 ; 열계량법
q반응계 = -q열량계
8. 3 엔탈피 (H)
q반응 = H = (H생성물 - H반응물)
발열반응 q = H < 0 (H생성물 < H반응물)
흡열반응 q = H > 0 (H생성물 > H반응물)
8. 4 열화학 반응식
H2(g) + Cl2(g) 2HCl(g) H = -185kJ
물질 상태를 표시해 주어야 한다. (상태마다 엔탈피가 틀리기 때문에)
열화학 반응식
H의 부호는 일정한 압력에서 반응이 진행될 때 흡열반응(+ H)인지 발열반응(- H)인지 암시한다.
열화학 반응식에서 계수는 몰수를 암시한다. (1mol H2 + 1mol Cl2 2mol HCl)
(s), (L), (g), (aq) 같은 기호를 사용하여 모든 화합물들의 물리적 상태를 기술한다.
열화학법칙
H의 크기는 반응물이나 생성물의 양에 비례한다.
한 반응의 H는 역반응의 H와 부호는 반대이고 크기는 같다.
반응에서의 H값은 반응이 한 단계로 진행되거나, 여러 단계를 거쳐 일어나거나 같은 값을 가진다.
반응식 = 반응식1 + 반응식2 … (Hess법칙)
H = H1 + H2 + …
8. 5 생성엔탈피
생성엔탈피 ( Hf )
25 , 1atm에서 안정한 상태의 원소들로부터 1mol의 화합물이 생성될 때(생성물)의 엔탈피 변화값
대체로 화합물의 엔탈피가 (-)값을 갖는데 이는 에너지를 잃고 안정한 상태가 되기 때문
안정한 상태의 원소들의 생성엔탈피를 0으로 정의
Hf 의 계산
Hf = Hf (생성물) - Hf (반응물)
표준상태에 있는 원소는 생략한다. 표준상태에서 원소의 생성열을 0이기 때문이다.
열화학 방정식에서 반응물과 생성물의 계수는 고려해야 한다. (mol수)
8. 6 결합에너지
결합엔탈피
1mol의 결합이 기체상태에서 끊어지는데 필요한 H로 정의
결합에너지 (KJ/mol)
H
C
N
O
S
F
Cl
Br
I
H
436
414
389
464
339
565
431
368
297
C
347
293
351
259
485
331
276
218
N
159
222
-
272
201
243
-
O
138
-
184
205
201
201
S
226
285
255
213
-
F
153
255
255
227
Cl
243
218
209
Br
193
180
I
151
다중결합에너지 (KJ/mol)
C=C
612
C=N
615
C=O
715
N=N
418
C=S
477
N=O
607
O=O
498
S=O
498
C C
820
C N
890
C O
1075
N N
941
반응물로의 결합이 생성물의 결합보다 강함
생성물보다 반응물ㄹ에 더 많은 결합이 있다.
H2O
5
AX5
90 , 120 , 180
삼각쌍뿔형
PF5
AX4E
90 , 120 , 180
시소형
SF4
AX3E2
90 , 180
T-형
ClF3
AX2E3
180
선형
XeF2
6
AX6
90 , 180
정팔면체
SF6
AX5E
90 , 180
사각피라미드
ClF5
AX4E2
90 , 180
평면사각형
XeF4
* 위의 분자들에서 관측된 결합각은 이상적인 결합각보다 약간 작다.
7. 3 분자의 극성
극성 : 전자의 비대칭적인 분포에 의하여 화학결합 또는 분자가 양극 또는 음극을 갖게 되는 것
쌍극자(dipole)라 부른다.
비극성 : 전자의 대칭적인 분포에 의하여 화학결합 또는 분자에 양극과 음극이 없다.
만일 한 분자가 세 개 이상의 원자로 구성되어 있다면
BeF2는 두 개의 Be-F 극성결합을 갖고 있지만 쌍극자가 놓여 있으므로 상쇄되어 극성을 잃는다.
산소가 수소보다 전기음성도가 더 크기 때문에 O-H 결합은 극성이며 산소원자 주위에서 전자밀도가
가장 높게 된다.
사염화탄소(CCl4)는 BeF2와 같이 극성결합을 가짐에도 불구하고 분자가 비극성을 갖는 예이다.
네 개의 결합이 탄소를 주위로 대칭적으로 놓여서 서로 상쇄되어 비극성이 된다.
7. 4 원자궤도 함수 ; 혼성
혼성궤도함수 : 2s의 궤도함수가 2p의 궤도함수와 혼성하여 새로운 2개의 sp혼성궤도함수를 형성
2s ( ) + 2p ( )( )( ) sp ( ) ( )( )( )
혼성궤도함수와 기하구조
전자쌍의 수
원자 궤도함수
혼성궤도함수
오비탈구조
보기
2
s, p
sp
선형
BeF2, CO2
3
s, 2개의 p
sp2
정삼각형
BF3, SO3
4
s, 3개의 p
sp3
사면체
CH4, NH3, H2O
5
s, 3개의 p, d
sp3d
삼각쌍뿔형
PCl5, SF4, ClF3
6
s, 3개의 p, 2개의 d
sp3d2
팔면체
SF6, ClF5, XeF4
1s
2s
2p
3s
3p
3d
BeF에서 Be원자
( )
( )
( )( )( )
BF3에서 B원자
( )
( )
( )( )( )
CH4에서 C원자
( )
( )
( )( )( )
PCl5에서 P원자
( )
( )
( )( )( )
( )
( )( )( )
( )( )( )( )( )
SF6에서 S원자
( )
( )
( )( )( )
( )
( )( )( )
( )( )( )( )( )
다중결합
이중결합이나 삼중결합에 추가되어 있는 전자쌍이 분자의 기하학적 구조에 큰 영향을 주지 않는다.
다중결합에 있는 추가된 전자쌍은 혼성궤도함수에 위치하지 않는다.
시그마결합과 파이결합
모든 단일결합은 시그마( )결합이다.
다중결합에서 한 개의 전자쌍은 시그마( )결합이고, 나머지는 파이( )결합이다.
제 8장 열화학
8. 1 열흐름의 원리
계 (system) : 우리가 관심의 대상으로 생각하는 우주의 일부분
주위 (surrounding) : 계와 에너지를 교환하며 계를 제외한 우주의 나머지 부분
열흐름의 방향과 부호
흡열과정 (q>0) : 열은 주위로부터 반응계로 흐른다.
열이 주위에서 계로 흘러들어갈 경우 q는 +이다.
발열과정 (q<0) : 열은 반응계로부터 주위로 흐른다.
열이 계에서 주위로 흘러나갈 경우 q는 -이다.
열흐름의 크기
q = C(열용량) t = m c(비열) t
열용량 : 계의 온도를 1 상승시키기 위하여 필요한 열량 [J/ ]
비열 : 순수한 물질 1g의 온도를 1 상승시키는데 필요한 열량 [J/g· ]
1cal = 4.184J
8. 2 열흐름의 측정 ; 열계량법
q반응계 = -q열량계
8. 3 엔탈피 (H)
q반응 = H = (H생성물 - H반응물)
발열반응 q = H < 0 (H생성물 < H반응물)
흡열반응 q = H > 0 (H생성물 > H반응물)
8. 4 열화학 반응식
H2(g) + Cl2(g) 2HCl(g) H = -185kJ
물질 상태를 표시해 주어야 한다. (상태마다 엔탈피가 틀리기 때문에)
열화학 반응식
H의 부호는 일정한 압력에서 반응이 진행될 때 흡열반응(+ H)인지 발열반응(- H)인지 암시한다.
열화학 반응식에서 계수는 몰수를 암시한다. (1mol H2 + 1mol Cl2 2mol HCl)
(s), (L), (g), (aq) 같은 기호를 사용하여 모든 화합물들의 물리적 상태를 기술한다.
열화학법칙
H의 크기는 반응물이나 생성물의 양에 비례한다.
한 반응의 H는 역반응의 H와 부호는 반대이고 크기는 같다.
반응에서의 H값은 반응이 한 단계로 진행되거나, 여러 단계를 거쳐 일어나거나 같은 값을 가진다.
반응식 = 반응식1 + 반응식2 … (Hess법칙)
H = H1 + H2 + …
8. 5 생성엔탈피
생성엔탈피 ( Hf )
25 , 1atm에서 안정한 상태의 원소들로부터 1mol의 화합물이 생성될 때(생성물)의 엔탈피 변화값
대체로 화합물의 엔탈피가 (-)값을 갖는데 이는 에너지를 잃고 안정한 상태가 되기 때문
안정한 상태의 원소들의 생성엔탈피를 0으로 정의
Hf 의 계산
Hf = Hf (생성물) - Hf (반응물)
표준상태에 있는 원소는 생략한다. 표준상태에서 원소의 생성열을 0이기 때문이다.
열화학 방정식에서 반응물과 생성물의 계수는 고려해야 한다. (mol수)
8. 6 결합에너지
결합엔탈피
1mol의 결합이 기체상태에서 끊어지는데 필요한 H로 정의
결합에너지 (KJ/mol)
H
C
N
O
S
F
Cl
Br
I
H
436
414
389
464
339
565
431
368
297
C
347
293
351
259
485
331
276
218
N
159
222
-
272
201
243
-
O
138
-
184
205
201
201
S
226
285
255
213
-
F
153
255
255
227
Cl
243
218
209
Br
193
180
I
151
다중결합에너지 (KJ/mol)
C=C
612
C=N
615
C=O
715
N=N
418
C=S
477
N=O
607
O=O
498
S=O
498
C C
820
C N
890
C O
1075
N N
941
반응물로의 결합이 생성물의 결합보다 강함
생성물보다 반응물ㄹ에 더 많은 결합이 있다.
추천자료
 [일반화학실험] 기체상수 결정 실험 예비보고서 및 문제 고찰
[일반화학실험] 기체상수 결정 실험 예비보고서 및 문제 고찰 [일반화학실험]아스피린합성(예비,결과모두 포함)
[일반화학실험]아스피린합성(예비,결과모두 포함) [일반화학실험]엔탈피 측정-예비보고서
[일반화학실험]엔탈피 측정-예비보고서 [일반화학실험] 아보가드로수의 결정
[일반화학실험] 아보가드로수의 결정 [일반화학레포트]균일촉매반응
[일반화학레포트]균일촉매반응 [일반화학실험] 평형상수의 결정
[일반화학실험] 평형상수의 결정 (일반화학실험) 크로마토그래피
(일반화학실험) 크로마토그래피 (일반화학실험) 헤스의 법칙
(일반화학실험) 헤스의 법칙 Oxtoby 일반화학 제6판 - 짝수형 솔루션
Oxtoby 일반화학 제6판 - 짝수형 솔루션 Oxtoby 일반화학 제 6판 홀수형 솔루션입니다
Oxtoby 일반화학 제 6판 홀수형 솔루션입니다 [일반화학실험] 크로마토그래피 : 혼합물을 분리하는 한 방법으로서 색소 분리를 통한 크로마...
[일반화학실험] 크로마토그래피 : 혼합물을 분리하는 한 방법으로서 색소 분리를 통한 크로마... [일반화학실험] 혼합물의 분리
[일반화학실험] 혼합물의 분리 [일반화학실험] (결과) 엔탈피 측정 : 산과 염기의 중화반응을 이용하여 엔탈피가 상태함수임...
[일반화학실험] (결과) 엔탈피 측정 : 산과 염기의 중화반응을 이용하여 엔탈피가 상태함수임...

























































소개글