목차
1. 실험제목
2. 실험목적
3. 실험이론
4. 실험기구 및 시약
5. 실험방법
6. 실험결과
7. 고찰
8. 주의사항
9. 이론보충
10.참고문헌
2. 실험목적
3. 실험이론
4. 실험기구 및 시약
5. 실험방법
6. 실험결과
7. 고찰
8. 주의사항
9. 이론보충
10.참고문헌
본문내용
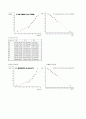
48.2
46.9
45.6
43.8
42.8
39.9
37.3
21.2
온도별 증기압
온도( )
{ P}_{1 }
{P}_{2}
{ P}_{3 }
80
54186.99459
406.4318804
353.35812
75
57529.01477
431.4988463
328.291154
70
64098.82258
480.775972
279.014028
65
69180.54546
518.8916527
240.898347
60
75332.10474
565.0316873
194.758313
55
78323.80696
587.4710783
172.318922
50
85000.84045
637.5524548
122.237545
45
89143.40844
668.6239639
91.1660361
5
99584.4899
746.9377439
12.8522561
증기압 문헌치 증발열 문헌치
7. 고찰
증발은 액체의 분자가 액체의 표면을 이탈하는 것이며 이는 상태변화의 한 과정이다. 이번 실험에서는 물이 증발할 때 이로 인한 증기압을 구하고 증발열을 구하는 실험이다.
물을 가열하면 온도가 증가하다가 끓는점에 도달하면 더 이상 온도가 증가하지 않는데 이때 물은 수증기가 되어 공기 중으로 흩어져 버리는 상태변화를 일으킨다. 물의 끓는점은 순수한 물(증류수)일 경우 100 에서 끓지만 실제적으로 주변의 기압에 따라 조금씩 다르게 된다. 끓는점이 일정한 이유는 가해준 물의 상태변화에 사용되기 때문이다.
온도를 80 까지 올린 후 최하 2 까지 내리면서 기체의 부피를 측정하여 증기압을 구한다. 실험은 물을 끓이는 실험이므로 부주의에 의한 화상, 화재의 위험이 있으므로 안전에 유의하며 해야 한다. 눈금 실린더를 거꾸로 사용하기 때문에 반드시 부피보정을 해주어야 하며 부피 측정시 눈금실린더와 물 높이가 물 높이가 비커내의 물 높이와 같아야 한다. 이것을 압력 보정이라 한다. 비커 안에 10㎖의 눈금 실린더를 넣은 후엔 압력이 일정하도록 실린더를 되도록 움직이지 않아야 한다. 이것이 실험의 오차를 발생하는 원인이 될 수 있다. 온도를 5 이하로 온도를 내리는 것은 이상기체 상태방정식(P공기압=n공기RT/V)의 n값을 알기 위해서 이다. 수증기가 거의 액체로 떨어져 공기만 남아 이때를 공기압이라 하고 이때의 공기의 몰수를 알 수 있기 때문이다.
5 공기=air(공기압) + H2O(수중기-증기압)
물을 가열할 때는 물의 온도를 균일하게 하기 위하여 가끔 저어준다
8. 주의사항
① 눈금 실린더를 거꾸로 사용하기 때문에 반드시 보정을 해주어야 한다.(부피보정)
② 부피 측정시 눈금실린더의 물 높이가 비커내의 물 높이와 같아야 한다.(압력보정)
③ 눈금 실린더가 비커내의 바닥에 닿아서는 안되고 너무 떨어져 있어도 안된다.
④ 물을 끓이는 실험이므로 부주의에 의한 화상, 화재의 위험이 있다, 안전에 유의해야 한다.
⑤ 모든 부피의 측정에서 0.2㎖를 빼주는 보정을 한다
9. 이론보충
4>① 기체에 관한 법칙
보일의 법칙 : 일정한 온도에서(T)에서 일정량의 기체의 부피(V)는 압력(P)에 반비례한다.
샤를의 법칙 : 일정한 압력에서 일정량의 기체는 온도가 1 오를 때마다 0 때 부피의 1/273만큼씩 증가 한다. 즉 압력이 일정할 때 일정량의 기체의 부피는 절대온도에 비례한다.
보일-샤를의 법칙 : 일정량의 기체의 부피는 압력에 반비례하고 절대 온도에 비례한다.
② 이상 기체 상태 방정식
기체 분자 운동론의 가정
기체 분자는 끊임없이 불규칙적인 직선 운동을 한다.
충돌시 에너지의 손실이 없다(완전 탄성체)
분자간의 인력, 반발력이 없다.
분자의 크기는 무시될 정도로 작다.
기체 분자의 평균 운동에너지는 분자의 종류나 크기에 관계없이 절대 온도에 비례한다.
Ek T
이상 기체 : 기체 분자 운동론의 가정에 정확하게 적용되는 가상적인 기체로, 이상 기체 방정식에 정확하게 적용된다.
이상 기체 상태 방정식
모든 기체 1몰의 부피는 0 , 1atm에서 22.4L이다.
위 값들을 보일-샤를의 법칙에 대입하여 k값을 구한다.
k=
=
0.082(atm L/mol K)=R ) 여기서 R을 기체 상수라 한다.
n몰의 기체일 때 다음의 식이 성립한다.
PV=nRT [P :압력(atm), V :부피(L), T : 온도(K) ]
n : 몰수, R : 0.082(atm L/mol K
이식을 이상 기체 상태 방정식이라 한다.
분자량이 M인 기체가 wg이 있다면 이상 기체 상태 방정식은 다음과 같으며 이식으로 기체의 분자량을
구할 수 있다.
PV =
RT, M =
=
(d(밀도)=
] )
이상 기체와 실제 기체의 비교
질량
부피
분자간 힘
저온, 저압
기체의 법칙
이상 기체
있음
없음
없음
기체
정확히 적용
실제 기체
있음
있음
있음
액체, 고체
대략 적용
실제 기체
분자간 힘이 작용하고, 분자 자체의 크기도 한다. 분자간 힘이 작고, 분자의 크기가 작을수록 이상 기체에 가깝게 행동한다. 낮은 압력, 높은 온도에서 이상 기체에 가깝게 행동한다.
증발열 : 액체 1g을 완전히 증발시키는 데 필요한 열량
증기 압력 : 액체와 그 증기가 동적 평형 상태에 있을 때, 증기가 나타내는 압력
온도가 높을수록 증기압력은 커진다.
분자간 인력이 작을수록(휘발성이 클수록) 증기압력이 크다.
9. 참고문헌
1>
http://kowon.dongseo.ac.kr/~binoh/chemistry/root/gener/ge_ex12_ob.htm
2>ttp://moolynaru.knu.ac.kr/second_middle/01material/02composition_rule/19gas_pre_vol/%C2%FC%B0%ED%C0%DA%B7%E1.htm
3>
http://dongyeolyoo.hihome.com/%C8%AD%C7%D0%C0%DA%B7%E1/%C8%AD%C7%D02/ch24.htm
4>
http://www.daeil.hs.kr/subjects/science/chemhome/mstate.htm
물리화학실험 자유아카데미 이문득 저
물리화학 R. Alberty and F. Daniels 탐구당
46.9
45.6
43.8
42.8
39.9
37.3
21.2
온도별 증기압
온도( )
{ P}_{1 }
{P}_{2}
{ P}_{3 }
80
54186.99459
406.4318804
353.35812
75
57529.01477
431.4988463
328.291154
70
64098.82258
480.775972
279.014028
65
69180.54546
518.8916527
240.898347
60
75332.10474
565.0316873
194.758313
55
78323.80696
587.4710783
172.318922
50
85000.84045
637.5524548
122.237545
45
89143.40844
668.6239639
91.1660361
5
99584.4899
746.9377439
12.8522561
증기압 문헌치 증발열 문헌치
7. 고찰
증발은 액체의 분자가 액체의 표면을 이탈하는 것이며 이는 상태변화의 한 과정이다. 이번 실험에서는 물이 증발할 때 이로 인한 증기압을 구하고 증발열을 구하는 실험이다.
물을 가열하면 온도가 증가하다가 끓는점에 도달하면 더 이상 온도가 증가하지 않는데 이때 물은 수증기가 되어 공기 중으로 흩어져 버리는 상태변화를 일으킨다. 물의 끓는점은 순수한 물(증류수)일 경우 100 에서 끓지만 실제적으로 주변의 기압에 따라 조금씩 다르게 된다. 끓는점이 일정한 이유는 가해준 물의 상태변화에 사용되기 때문이다.
온도를 80 까지 올린 후 최하 2 까지 내리면서 기체의 부피를 측정하여 증기압을 구한다. 실험은 물을 끓이는 실험이므로 부주의에 의한 화상, 화재의 위험이 있으므로 안전에 유의하며 해야 한다. 눈금 실린더를 거꾸로 사용하기 때문에 반드시 부피보정을 해주어야 하며 부피 측정시 눈금실린더와 물 높이가 물 높이가 비커내의 물 높이와 같아야 한다. 이것을 압력 보정이라 한다. 비커 안에 10㎖의 눈금 실린더를 넣은 후엔 압력이 일정하도록 실린더를 되도록 움직이지 않아야 한다. 이것이 실험의 오차를 발생하는 원인이 될 수 있다. 온도를 5 이하로 온도를 내리는 것은 이상기체 상태방정식(P공기압=n공기RT/V)의 n값을 알기 위해서 이다. 수증기가 거의 액체로 떨어져 공기만 남아 이때를 공기압이라 하고 이때의 공기의 몰수를 알 수 있기 때문이다.
5 공기=air(공기압) + H2O(수중기-증기압)
물을 가열할 때는 물의 온도를 균일하게 하기 위하여 가끔 저어준다
8. 주의사항
① 눈금 실린더를 거꾸로 사용하기 때문에 반드시 보정을 해주어야 한다.(부피보정)
② 부피 측정시 눈금실린더의 물 높이가 비커내의 물 높이와 같아야 한다.(압력보정)
③ 눈금 실린더가 비커내의 바닥에 닿아서는 안되고 너무 떨어져 있어도 안된다.
④ 물을 끓이는 실험이므로 부주의에 의한 화상, 화재의 위험이 있다, 안전에 유의해야 한다.
⑤ 모든 부피의 측정에서 0.2㎖를 빼주는 보정을 한다
9. 이론보충
4>① 기체에 관한 법칙
보일의 법칙 : 일정한 온도에서(T)에서 일정량의 기체의 부피(V)는 압력(P)에 반비례한다.
샤를의 법칙 : 일정한 압력에서 일정량의 기체는 온도가 1 오를 때마다 0 때 부피의 1/273만큼씩 증가 한다. 즉 압력이 일정할 때 일정량의 기체의 부피는 절대온도에 비례한다.
보일-샤를의 법칙 : 일정량의 기체의 부피는 압력에 반비례하고 절대 온도에 비례한다.
② 이상 기체 상태 방정식
기체 분자 운동론의 가정
기체 분자는 끊임없이 불규칙적인 직선 운동을 한다.
충돌시 에너지의 손실이 없다(완전 탄성체)
분자간의 인력, 반발력이 없다.
분자의 크기는 무시될 정도로 작다.
기체 분자의 평균 운동에너지는 분자의 종류나 크기에 관계없이 절대 온도에 비례한다.
Ek T
이상 기체 : 기체 분자 운동론의 가정에 정확하게 적용되는 가상적인 기체로, 이상 기체 방정식에 정확하게 적용된다.
이상 기체 상태 방정식
모든 기체 1몰의 부피는 0 , 1atm에서 22.4L이다.
위 값들을 보일-샤를의 법칙에 대입하여 k값을 구한다.
k=
=
0.082(atm L/mol K)=R ) 여기서 R을 기체 상수라 한다.
n몰의 기체일 때 다음의 식이 성립한다.
PV=nRT [P :압력(atm), V :부피(L), T : 온도(K) ]
n : 몰수, R : 0.082(atm L/mol K
이식을 이상 기체 상태 방정식이라 한다.
분자량이 M인 기체가 wg이 있다면 이상 기체 상태 방정식은 다음과 같으며 이식으로 기체의 분자량을
구할 수 있다.
PV =
RT, M =
=
(d(밀도)=
] )
이상 기체와 실제 기체의 비교
질량
부피
분자간 힘
저온, 저압
기체의 법칙
이상 기체
있음
없음
없음
기체
정확히 적용
실제 기체
있음
있음
있음
액체, 고체
대략 적용
실제 기체
분자간 힘이 작용하고, 분자 자체의 크기도 한다. 분자간 힘이 작고, 분자의 크기가 작을수록 이상 기체에 가깝게 행동한다. 낮은 압력, 높은 온도에서 이상 기체에 가깝게 행동한다.
증발열 : 액체 1g을 완전히 증발시키는 데 필요한 열량
증기 압력 : 액체와 그 증기가 동적 평형 상태에 있을 때, 증기가 나타내는 압력
온도가 높을수록 증기압력은 커진다.
분자간 인력이 작을수록(휘발성이 클수록) 증기압력이 크다.
9. 참고문헌
1>
http://kowon.dongseo.ac.kr/~binoh/chemistry/root/gener/ge_ex12_ob.htm
2>ttp://moolynaru.knu.ac.kr/second_middle/01material/02composition_rule/19gas_pre_vol/%C2%FC%B0%ED%C0%DA%B7%E1.htm
3>
http://dongyeolyoo.hihome.com/%C8%AD%C7%D0%C0%DA%B7%E1/%C8%AD%C7%D02/ch24.htm
4>
http://www.daeil.hs.kr/subjects/science/chemhome/mstate.htm
물리화학실험 자유아카데미 이문득 저
물리화학 R. Alberty and F. Daniels 탐구당
































소개글