목차
사 전 보 고 서
1. 실험 목적
2. 실험 이론
4. 실험시약
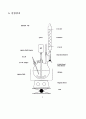
5. 실험장치
결 과 보 고 서
1. 계산 및 결과
2. Opinion
1. 실험 목적
2. 실험 이론
4. 실험시약
5. 실험장치
결 과 보 고 서
1. 계산 및 결과
2. Opinion
본문내용
서 끓기 시작하여 공비혼합물(98.54% 수용액)이 된다. 순황산(100% 황산) 및 진한 황산은 물과의 친화력(親和力)이 강하여 혼합하면 강하게 발열한다. 또 물과 강하게 결합할 뿐만 아니라 강력한 탈수작용이 있어, 다른 여러 가지 화합물로부터 산소와 수소를 빼앗기 때문에 각종 건조제탈수제로 사용되며, 설탕이나 섬유 등에 황산을 작용시키면 탈수되어 탄소가 유리된다. 진한 황산에 삼산화황을 녹인 발연황산은 탈수작용이나 산화작용이 휠씬 강하다.
진한 황산은 저온에서는 산화작용이 강하지 않지만 가열하면 강한 산화작용을 나타낸다. 황산수용액, 즉 보통 말하는 황산은 무색의 용액으로 강한 이염기산이다. 해리도(解離度)는 1 N에서 51%, 0.1 N에서 59%, 묽은 용액에서는 H2SO4 ↔ H++HSO4- 으로 해리가 완전히 이루어진다. HSO4- ↔ H++SO42- 의 이온화상수는 [H+][HSO4-]/[H2SO4]=0.02(18℃) 이다. 아연철마그네슘알루미늄 등의 각종 금속은 묽은 황산에 녹아서 수소를 발생하고 황산염을 만든다. 진한 황산은 낮은 온도에서는 이들 금속과 반응하지 않지만 가열하면 이산화황을 발생하고 황산염을 만든다. 또한 각종 유기화합물, 특히 방향족 화합물과 반응하여 술폰산을 만든다. 황산이온의 존재는 염화바륨을 가할 때 흰 앙금이 생기므로 검출할 수 있다.
일반적으로 접촉식으로 만든 것은 98% 이상으로 농도가 높고 무색인 것이 얻어지지만, 탑산(塔酸) 등에서는 셀렌유기물 등으로 인해서 붉은 보라색 또는 흑갈색을 띠며, 농도는 57~59°B(보메도)로 상당히 묽다. 이들 묽은 황산은 운반이나 부식 등의 이유 때문에 65 °B까지 농축시켜 과인산석회나 황산암모늄의 제조나 철의 녹 제거 등에 사용된다.
2. 용도
화학공업에서 기초원료로 가장 중요한 것 중의 하나이다. 금속제련 제강 방직 제지 식품 등의 각종 공업에 광범위하게 사용되고 있으며, 이 밖에 실험실용 시약 의약품으로서의 용도도 많다.
예를 들면, 제조화학에서는 황산암모늄 과인산석회 망초(芒硝) 황산칼륨 석고 술폰산 또는 그 염, 이 밖에 질산 염산 인산 아세트산 크롬산 등과 같은 각종 산, 인산암모늄 황화수소 염소 인조섬유 합성섬유 염료 산화티탄 리토폰 페놀 등의 제조에 사용된다. 촉매로 사용되는 경우도 있고, 아세트산 아세트산셀룰로오스, 각종 에스테르의 제조, 석유의 분해 등에도 사용된다.
니트로벤젠 니트로글리세롤 니트로셀룰로오스 등의 제조에는 니트로화 시약으로 진한 황산이 조제(助劑)로 필요하며, 알데히드 숙신산 옥시산, 케톤 등에서는 산화조제(酸化助劑), 아연 철 알루미늄 나트륨 등에 의해서 각종 유기화합물을 만들 때에는 환원조제(還元助劑)로 사용된다.
또 철강 황동 청동 구리 은 등의 녹 제거나, 석유 유지 그리스 타르 지방산 등의 세정에 다량으로 사용된다. 이 밖에 녹말 목재의 당화(糖化)나 방부제 제초제 살균제 살충제 매염제(媒染劑) 축전지 피혁의 탈모제로도 쓴다.
5. 실험장치
결 과 보 고 서
제목 : Isoamylacetate 합성
1. 계산 및 결과
최초 투입시 계산량은
acetic acid
isoamyl alcohol
생성물(isoamyl acetate)
153ml
97.16ml
생성물의 량을 예측할수 있다.
구 분
acetic acid
isoamyl alcohol
생성물
(isoamyl acetate)
몰
2.67mol
0.89mol
0.89mol
밀도
1.049
0.809
분자량
60
88.15
130
투입량
153ml
97.16ml
143ml
실험도중에 dean stark에서 빠져나온 물의 량이 일부 있고, 그때 받은 량은 다음과 같다.
구 분
빈 비커
H2O + 비커
H2O
무 게
62.4g
86.5g
24.1g
▶ 이소아밀아세테이트 정제
H2O투입량
H2O + H2SO4 + A.A량
washing량
100ml
130ml
30ml
50ml
80ml
30ml
50ml
71ml
21ml
50ml
53ml
3ml
50ml
51ml
1ml
50ml
51ml
1ml
100ml
100ml
0ml
86ml
※ 분액깔때기를 조금 흔들 경우, washing하기 위해 투입된 물과 이소아밀아세테이트 혼합물이 잘 섞이지 않고 층을 유지한 채 잘 섞이지 않는 것을 확인하였다. 이에 층이 없어질 정도로 충분히 흔들었을 때 계면에 거품이 많이 생기고 점차 거품이 사라지면서 다시 층을 이루는 것을 확인하였다.
▶ 이소아밀 아세테이트의 수율
(1) 이론 수율
한계 반응물인 0.89mol 투입됐으므로 생성물도 0.89mol 생성되어야 한다.
이소아밀 아세테이트의 이론적 수율은 143ml 이다.
(2) 실제 수율
구 분
정제 전(前)
이소아밀 아세테이트
혼합물
정제시 빠져나간 이소아밀 아세테이트 혼합물
실(實)
이소아밀 아세테이트
내 용
250ml
110ml
140ml
▶ 평균표준오차와 상대표준오차
(1) 평균표준오차
일어날 확률을 알 수 없기 때문에 평균값의 표준편차를 구할 수 없다.
따라서 평균표준오차도 구할 수 없다.
(2) 상대표준오차
2. Opinion
이번 실험은 통해 반응물의 양과 촉매에 따라 생성물의 수율에 각각 어떠한 영향을 미치는가에 대해 알아본 실험이었다.
하지만 반응물의 양에 따른 결과값에 미치는 영향은 알 수가 없다. 다만 반응속도 상수식(반응물의 농도가 클수록 반응이 더 잘 일어난다)을 통해 한계 반응물의 양과 수율은 비례한다는 것을 추측할 수 있다.
오차로 생각되는 것으로 첫 번째로 온도를 올리고 나서 Dean stark의 온도가 96℃가 되면서 물이 생성될시 물이외의 물질도 같이 나와서 오차의 원인 되었고, 또 액층이 분리가 되질 않았는데 그때 분리가 적절하지 못해서 오차가 발생할 것으로 추측된다. washing시 혼합물에서 분리되어지는 불순물의 량이 규칙적으로 나와야 하는데 불규칙적이어서 계면의 이소아밀아세테이트가 분리시 물과 함께 밖으로 나온 것으로 생각되어진다.
사실 오차는 얼마 나오지 않았지만 실제 수득량에서 이소아밀아세테이트의 순도가 염려스럽다. 물을 걸러낼때 액층이 분리가 확실하게 보이지 않아서 거기서 잘못된점이 있다고 생각이 된다.
진한 황산은 저온에서는 산화작용이 강하지 않지만 가열하면 강한 산화작용을 나타낸다. 황산수용액, 즉 보통 말하는 황산은 무색의 용액으로 강한 이염기산이다. 해리도(解離度)는 1 N에서 51%, 0.1 N에서 59%, 묽은 용액에서는 H2SO4 ↔ H++HSO4- 으로 해리가 완전히 이루어진다. HSO4- ↔ H++SO42- 의 이온화상수는 [H+][HSO4-]/[H2SO4]=0.02(18℃) 이다. 아연철마그네슘알루미늄 등의 각종 금속은 묽은 황산에 녹아서 수소를 발생하고 황산염을 만든다. 진한 황산은 낮은 온도에서는 이들 금속과 반응하지 않지만 가열하면 이산화황을 발생하고 황산염을 만든다. 또한 각종 유기화합물, 특히 방향족 화합물과 반응하여 술폰산을 만든다. 황산이온의 존재는 염화바륨을 가할 때 흰 앙금이 생기므로 검출할 수 있다.
일반적으로 접촉식으로 만든 것은 98% 이상으로 농도가 높고 무색인 것이 얻어지지만, 탑산(塔酸) 등에서는 셀렌유기물 등으로 인해서 붉은 보라색 또는 흑갈색을 띠며, 농도는 57~59°B(보메도)로 상당히 묽다. 이들 묽은 황산은 운반이나 부식 등의 이유 때문에 65 °B까지 농축시켜 과인산석회나 황산암모늄의 제조나 철의 녹 제거 등에 사용된다.
2. 용도
화학공업에서 기초원료로 가장 중요한 것 중의 하나이다. 금속제련 제강 방직 제지 식품 등의 각종 공업에 광범위하게 사용되고 있으며, 이 밖에 실험실용 시약 의약품으로서의 용도도 많다.
예를 들면, 제조화학에서는 황산암모늄 과인산석회 망초(芒硝) 황산칼륨 석고 술폰산 또는 그 염, 이 밖에 질산 염산 인산 아세트산 크롬산 등과 같은 각종 산, 인산암모늄 황화수소 염소 인조섬유 합성섬유 염료 산화티탄 리토폰 페놀 등의 제조에 사용된다. 촉매로 사용되는 경우도 있고, 아세트산 아세트산셀룰로오스, 각종 에스테르의 제조, 석유의 분해 등에도 사용된다.
니트로벤젠 니트로글리세롤 니트로셀룰로오스 등의 제조에는 니트로화 시약으로 진한 황산이 조제(助劑)로 필요하며, 알데히드 숙신산 옥시산, 케톤 등에서는 산화조제(酸化助劑), 아연 철 알루미늄 나트륨 등에 의해서 각종 유기화합물을 만들 때에는 환원조제(還元助劑)로 사용된다.
또 철강 황동 청동 구리 은 등의 녹 제거나, 석유 유지 그리스 타르 지방산 등의 세정에 다량으로 사용된다. 이 밖에 녹말 목재의 당화(糖化)나 방부제 제초제 살균제 살충제 매염제(媒染劑) 축전지 피혁의 탈모제로도 쓴다.
5. 실험장치
결 과 보 고 서
제목 : Isoamylacetate 합성
1. 계산 및 결과
최초 투입시 계산량은
acetic acid
isoamyl alcohol
생성물(isoamyl acetate)
153ml
97.16ml
생성물의 량을 예측할수 있다.
구 분
acetic acid
isoamyl alcohol
생성물
(isoamyl acetate)
몰
2.67mol
0.89mol
0.89mol
밀도
1.049
0.809
분자량
60
88.15
130
투입량
153ml
97.16ml
143ml
실험도중에 dean stark에서 빠져나온 물의 량이 일부 있고, 그때 받은 량은 다음과 같다.
구 분
빈 비커
H2O + 비커
H2O
무 게
62.4g
86.5g
24.1g
▶ 이소아밀아세테이트 정제
H2O투입량
H2O + H2SO4 + A.A량
washing량
100ml
130ml
30ml
50ml
80ml
30ml
50ml
71ml
21ml
50ml
53ml
3ml
50ml
51ml
1ml
50ml
51ml
1ml
100ml
100ml
0ml
86ml
※ 분액깔때기를 조금 흔들 경우, washing하기 위해 투입된 물과 이소아밀아세테이트 혼합물이 잘 섞이지 않고 층을 유지한 채 잘 섞이지 않는 것을 확인하였다. 이에 층이 없어질 정도로 충분히 흔들었을 때 계면에 거품이 많이 생기고 점차 거품이 사라지면서 다시 층을 이루는 것을 확인하였다.
▶ 이소아밀 아세테이트의 수율
(1) 이론 수율
한계 반응물인 0.89mol 투입됐으므로 생성물도 0.89mol 생성되어야 한다.
이소아밀 아세테이트의 이론적 수율은 143ml 이다.
(2) 실제 수율
구 분
정제 전(前)
이소아밀 아세테이트
혼합물
정제시 빠져나간 이소아밀 아세테이트 혼합물
실(實)
이소아밀 아세테이트
내 용
250ml
110ml
140ml
▶ 평균표준오차와 상대표준오차
(1) 평균표준오차
일어날 확률을 알 수 없기 때문에 평균값의 표준편차를 구할 수 없다.
따라서 평균표준오차도 구할 수 없다.
(2) 상대표준오차
2. Opinion
이번 실험은 통해 반응물의 양과 촉매에 따라 생성물의 수율에 각각 어떠한 영향을 미치는가에 대해 알아본 실험이었다.
하지만 반응물의 양에 따른 결과값에 미치는 영향은 알 수가 없다. 다만 반응속도 상수식(반응물의 농도가 클수록 반응이 더 잘 일어난다)을 통해 한계 반응물의 양과 수율은 비례한다는 것을 추측할 수 있다.
오차로 생각되는 것으로 첫 번째로 온도를 올리고 나서 Dean stark의 온도가 96℃가 되면서 물이 생성될시 물이외의 물질도 같이 나와서 오차의 원인 되었고, 또 액층이 분리가 되질 않았는데 그때 분리가 적절하지 못해서 오차가 발생할 것으로 추측된다. washing시 혼합물에서 분리되어지는 불순물의 량이 규칙적으로 나와야 하는데 불규칙적이어서 계면의 이소아밀아세테이트가 분리시 물과 함께 밖으로 나온 것으로 생각되어진다.
사실 오차는 얼마 나오지 않았지만 실제 수득량에서 이소아밀아세테이트의 순도가 염려스럽다. 물을 걸러낼때 액층이 분리가 확실하게 보이지 않아서 거기서 잘못된점이 있다고 생각이 된다.
































소개글