목차
예비
1. 실험 제목
2. 실험조 및 실험자
3. 실험 목적
4. 실험 이론 및 배경
5. 장치 및 시약
6. 실험 방법
7. 참고 문헌
결과:
1. 실험 제목
2. 실험조 및 실험자
3. 실험 결과
4. 토의 및 고찰 (실험 기본 이론+토의/고찰)
5. 참고 문헌
1. 실험 제목
2. 실험조 및 실험자
3. 실험 목적
4. 실험 이론 및 배경
5. 장치 및 시약
6. 실험 방법
7. 참고 문헌
결과:
1. 실험 제목
2. 실험조 및 실험자
3. 실험 결과
4. 토의 및 고찰 (실험 기본 이론+토의/고찰)
5. 참고 문헌
본문내용
.5
10
1.6475
0.87
25.92
250
10
2.1967
0.9233
42.45
1) 12.5ml 실험
- = = 0.1098N = 0.1098M
- = = 0.0333N = 0.0333M
- =
= 2.55mol/kg = 2.55N
2) 25ml 실험
- = = 0.2197N = 0.2197M
- = = 0.0853N = 0.0853M
- =
= 4.48mol/kg = 4.48 N
3) 62.5ml 실험
- = = 0.5492N = 0.5492M
- = = 0.22N = 0.22 M
- =
= 10.97mol/kg = 10.97N
4) 125ml 실험
- = = 1.0983N = 1.0983M
- = = 0.4867N = 0.4867M
- =
= 20.39mol/kg = 20.39N
5) 187.5ml 실험
- = = 1.6475N = 1.6475M
- = = 0.87N = 0.87M
- =
= 25.92mol/kg = 25.92N
6) 250ml 실험
- = = 2.1967N = 2.1967M
- = = 0.9233N = 0.9233M
- =
= 42.45mol/kg = 42.45N
○ -
(ml)
log
log
12.5
0.0333
2.55
-1.4775
0.4065
25
0.0853
4.48
-1.0690
0.6512
62.5
0.22
10.97
-0.6575
1.0402
125
0.4867
20.39
-0.3127
1.3094
187.5
0.87
25.92
-0.0604
1.4136
250
0.9233
42.45
-0.0346
1.6278
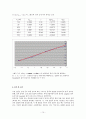
그래프 도시 결과 y = 0.8004x + 1.5566 으로, 활성탄의 흡착 등온식에 해당하는
범위 내에 해당하므로, 실험한 농도 범위에서
Freundlich의 흡착 등온식이 적합함을 알 수 있다.
4. 토의 및 고찰
이번 실험은 일정 온도 하에 농도에 따른 시트르산 용액의 활성탄 표면에서의 흡착 정도를 통해, 용액 상에서 고체 분말 표면에 흡착하는 액체 피흡착질의 흡착 양상을 Langmuir 흡착 등온식과 Freundlich 흡착 든온식으로 알아보는 실험이었다.
흡착이란 기체상 또는 액체상인 물질이 물리적 힘이나 화학적 힘에 의해 다른 물질의 표면(액체상 또는 고체상)에 달라붙는 현상이다. 즉, 고체 표면의 분자나 이온들은 다른 입자들과의 결합에 의해 안정되는데, 이 때 결합을 이루지 못한 표면이 있을 때는 잉여력을 갖게 되고, 이러한 불포화의 결과로 고체(액체)는 접촉하고 있는 기체 또는 용해된 물질을 고체(액체) 표면으로 끌어당겨 붙잡아 두려는 경향이 생기고, 노출된 입자들 사이에는 인력이 작용하기 때문에 기체 또는 용해된 물질(피흡착질)은 고체상 물질(흡착제)의 표면에 가역적으로 달라붙게 된다. 이 때 계면에서의 농도가 증가하면 정흡착, 감소하면 부흡착이라 한다.
흡착이 일어나는 정도는 고체 및, 흡착하는 분자의 특성에 따라 다르며 또한 농도, 압력 및 온도에 따라서 변화하는데, 대부분의 고체들은 다량의 기체와 액체 용액의 용질을 흡착하는 성질을 가지진다. 이러한 고체 표면의 흡착력은 흡착된 물질의 양, 흡착제의 단위 질량당 흡착면적 측정으로 결정되는데, 이번 실험에서 사용한 활성탄의 경우, 아주 잘게 쪼개질 수 있어서 흡착할 수 있는 표면적이 매우 크기에 가장 좋은 흡착제 중 하나로 여겨진다.
이러한 흡착되는 물질의 양은 계의 종류와 대상 물질의 부분압 또는 농도에 따라 변하는 함수로, 그 관계는 여러 종류의 흡착 등온식으로 기술되며, 어떤 흡착 등온식이 적합한가는 실험으로 확인되어야 한다.
실험값을 살펴보면,
값의 증가, 즉 용액 내 시트르산의 농도 증가에 따라 도 증가함을 통해, 흡착률이 흡착 대상 물질의 농도에 비례함을 확인할 수 있었고, - 의 그래프 도시를 통해, 활성탄의 흡착이 Freundlich의 흡착 등온식을 만족함을 알 수 있었다.
[ Freundlich의 흡착 등온식의 적합성 범위:
-그래프 도시 결과 y = 0.8004x + 1.5566 로 Freundlich의 흡착 등온식 만족]
다만, =125에서의 NaOH 적정량(ml)과, =187.5와 =250의 에 대한 log 값의 경우, 전체적인 경향과 달리 크게 증가하였는데,
이러한 오차의 가장 큰 원인으로는 NaOH 적정 과정의 부정확성을 꼽을 수 있다. 즉, 염기성에서 붉게 변하는 페놀트탈레인을 이용하여 NaOH-아세트산 중화 반응의 종말점을 찾는 것이 실험의 주된 과정이었는데, 이러한 색변화 관찰 자체가 상당히 주관적이고, NaOH의 적정량 측정 역시 실험자에 따라 약간의 차이가 발생할 수 있다. 또 적정에 사용된 NaOH 용액도 동일한 사람이 만든 것을 나눠 쓴 것이 아니라 조별로 각자 만들어 썼기에 그 농도에 있어 약간의 차이가 발생했을 수 있다.
또한 이번 실험은 일정한 온도 하에 농도에 따른 흡착률을 알아보는 것이었는데, 실험 시 특별한 항온 절차 없이 상온에서 실험을 하였고, 이 과정에서 발생한 온도의 미세한 차이(흡착 과정에서는 열이 발생함)가 실험 결과에 영향을 미친 것 생각된다. 하지만 용액의 농도가 묽고 흡착되는 양도 적기 때문에 이로 인해 발생하는 열은 무시할 수 있을 것으로도 생각된다.
마지막으로, 용액과 활성탄을 섞는 과정에서 활성탄이 고르게 분배 되지 않아, 충분한 흡착이 이루어지지 않았을 수 있고, 여과 과정에서도 거름 종이에 따라 오차가 발생할 수 있다.
하지만, 이러한 여러 오차 원인들을 고려할지라도, 실험 결과값을 살펴봤을 때, 비교적 정확한 실험이 이루어 졌다고 판단된다.
5. 참고 문헌
물리화학실험, 대한화학회, 청문각, 2008, p87-91
물리화학의 원리, 이재원, 학문사, 1999, p247-249
물리화학, IRAN LEVINE, 자유아카데미, 2003, p147-153
Physical chemistry, Atkins, Oxford, 1990, pp885-890
http://chemistory.tistory.com
http://www.kosha.net/index.jsp (MSDS)
http://blog.daum.net/koreacjb/6272594 (흡착 등온식의 종류)
10
1.6475
0.87
25.92
250
10
2.1967
0.9233
42.45
1) 12.5ml 실험
- = = 0.1098N = 0.1098M
- = = 0.0333N = 0.0333M
- =
= 2.55mol/kg = 2.55N
2) 25ml 실험
- = = 0.2197N = 0.2197M
- = = 0.0853N = 0.0853M
- =
= 4.48mol/kg = 4.48 N
3) 62.5ml 실험
- = = 0.5492N = 0.5492M
- = = 0.22N = 0.22 M
- =
= 10.97mol/kg = 10.97N
4) 125ml 실험
- = = 1.0983N = 1.0983M
- = = 0.4867N = 0.4867M
- =
= 20.39mol/kg = 20.39N
5) 187.5ml 실험
- = = 1.6475N = 1.6475M
- = = 0.87N = 0.87M
- =
= 25.92mol/kg = 25.92N
6) 250ml 실험
- = = 2.1967N = 2.1967M
- = = 0.9233N = 0.9233M
- =
= 42.45mol/kg = 42.45N
○ -
(ml)
log
log
12.5
0.0333
2.55
-1.4775
0.4065
25
0.0853
4.48
-1.0690
0.6512
62.5
0.22
10.97
-0.6575
1.0402
125
0.4867
20.39
-0.3127
1.3094
187.5
0.87
25.92
-0.0604
1.4136
250
0.9233
42.45
-0.0346
1.6278
그래프 도시 결과 y = 0.8004x + 1.5566 으로, 활성탄의 흡착 등온식에 해당하는
범위 내에 해당하므로, 실험한 농도 범위에서
Freundlich의 흡착 등온식이 적합함을 알 수 있다.
4. 토의 및 고찰
이번 실험은 일정 온도 하에 농도에 따른 시트르산 용액의 활성탄 표면에서의 흡착 정도를 통해, 용액 상에서 고체 분말 표면에 흡착하는 액체 피흡착질의 흡착 양상을 Langmuir 흡착 등온식과 Freundlich 흡착 든온식으로 알아보는 실험이었다.
흡착이란 기체상 또는 액체상인 물질이 물리적 힘이나 화학적 힘에 의해 다른 물질의 표면(액체상 또는 고체상)에 달라붙는 현상이다. 즉, 고체 표면의 분자나 이온들은 다른 입자들과의 결합에 의해 안정되는데, 이 때 결합을 이루지 못한 표면이 있을 때는 잉여력을 갖게 되고, 이러한 불포화의 결과로 고체(액체)는 접촉하고 있는 기체 또는 용해된 물질을 고체(액체) 표면으로 끌어당겨 붙잡아 두려는 경향이 생기고, 노출된 입자들 사이에는 인력이 작용하기 때문에 기체 또는 용해된 물질(피흡착질)은 고체상 물질(흡착제)의 표면에 가역적으로 달라붙게 된다. 이 때 계면에서의 농도가 증가하면 정흡착, 감소하면 부흡착이라 한다.
흡착이 일어나는 정도는 고체 및, 흡착하는 분자의 특성에 따라 다르며 또한 농도, 압력 및 온도에 따라서 변화하는데, 대부분의 고체들은 다량의 기체와 액체 용액의 용질을 흡착하는 성질을 가지진다. 이러한 고체 표면의 흡착력은 흡착된 물질의 양, 흡착제의 단위 질량당 흡착면적 측정으로 결정되는데, 이번 실험에서 사용한 활성탄의 경우, 아주 잘게 쪼개질 수 있어서 흡착할 수 있는 표면적이 매우 크기에 가장 좋은 흡착제 중 하나로 여겨진다.
이러한 흡착되는 물질의 양은 계의 종류와 대상 물질의 부분압 또는 농도에 따라 변하는 함수로, 그 관계는 여러 종류의 흡착 등온식으로 기술되며, 어떤 흡착 등온식이 적합한가는 실험으로 확인되어야 한다.
실험값을 살펴보면,
값의 증가, 즉 용액 내 시트르산의 농도 증가에 따라 도 증가함을 통해, 흡착률이 흡착 대상 물질의 농도에 비례함을 확인할 수 있었고, - 의 그래프 도시를 통해, 활성탄의 흡착이 Freundlich의 흡착 등온식을 만족함을 알 수 있었다.
[ Freundlich의 흡착 등온식의 적합성 범위:
-그래프 도시 결과 y = 0.8004x + 1.5566 로 Freundlich의 흡착 등온식 만족]
다만, =125에서의 NaOH 적정량(ml)과, =187.5와 =250의 에 대한 log 값의 경우, 전체적인 경향과 달리 크게 증가하였는데,
이러한 오차의 가장 큰 원인으로는 NaOH 적정 과정의 부정확성을 꼽을 수 있다. 즉, 염기성에서 붉게 변하는 페놀트탈레인을 이용하여 NaOH-아세트산 중화 반응의 종말점을 찾는 것이 실험의 주된 과정이었는데, 이러한 색변화 관찰 자체가 상당히 주관적이고, NaOH의 적정량 측정 역시 실험자에 따라 약간의 차이가 발생할 수 있다. 또 적정에 사용된 NaOH 용액도 동일한 사람이 만든 것을 나눠 쓴 것이 아니라 조별로 각자 만들어 썼기에 그 농도에 있어 약간의 차이가 발생했을 수 있다.
또한 이번 실험은 일정한 온도 하에 농도에 따른 흡착률을 알아보는 것이었는데, 실험 시 특별한 항온 절차 없이 상온에서 실험을 하였고, 이 과정에서 발생한 온도의 미세한 차이(흡착 과정에서는 열이 발생함)가 실험 결과에 영향을 미친 것 생각된다. 하지만 용액의 농도가 묽고 흡착되는 양도 적기 때문에 이로 인해 발생하는 열은 무시할 수 있을 것으로도 생각된다.
마지막으로, 용액과 활성탄을 섞는 과정에서 활성탄이 고르게 분배 되지 않아, 충분한 흡착이 이루어지지 않았을 수 있고, 여과 과정에서도 거름 종이에 따라 오차가 발생할 수 있다.
하지만, 이러한 여러 오차 원인들을 고려할지라도, 실험 결과값을 살펴봤을 때, 비교적 정확한 실험이 이루어 졌다고 판단된다.
5. 참고 문헌
물리화학실험, 대한화학회, 청문각, 2008, p87-91
물리화학의 원리, 이재원, 학문사, 1999, p247-249
물리화학, IRAN LEVINE, 자유아카데미, 2003, p147-153
Physical chemistry, Atkins, Oxford, 1990, pp885-890
http://chemistory.tistory.com
http://www.kosha.net/index.jsp (MSDS)
http://blog.daum.net/koreacjb/6272594 (흡착 등온식의 종류)






































소개글