목차
Ⅰ. 서론
Ⅱ. 이론
Ⅲ. 실험방법
Ⅳ. 결과 및 토론
Ⅴ. 결론
Ⅵ. 참고문헌
Ⅱ. 이론
Ⅲ. 실험방법
Ⅳ. 결과 및 토론
Ⅴ. 결론
Ⅵ. 참고문헌
본문내용
)를 이용하여 전도도를 y에 대입하면 농도(X)를 구할 수 있다.
『C(mol/l)구하는 과정』
▶flow rate(ml/min)가
⇒ 100일때, 3150 = 145220X + 124.27 ⇒ X = 0.0208
⇒ 150일때, 3270 = 145220X + 124.27 ⇒ X = 0.0216
⇒ 200일때, 3490 = 145220X + 124.27 ⇒ X = 0.0232
1-4. t과 전환율(X) 구하기
▶t(residence time = ) 과 전환율(X)
flow rate(ml/min)
t()
100
9.6
1.38095
150
6.4
1.32558
200
4.8
1.17391
『t구하는 과정』
▶ t = 이고, V =960ml 이다.
그러므로 flow rate(ml/min)가
⇒ 100(ml/min) 일때, t = = 9.6min
⇒ 150(mi/min) 일때, t = = 6.4min
⇒ 200(ml/min) 일때, t = = 4.8min
『전환율(X) 구하는 과정』
▶ 온도, 부피, 압력이 일정할때,
C = C(1-X) ⇒ = 1-X ⇒ ∴ X = 1 -
그러므로 C와 C(초기농도 = 0.05M)를 알고 있으면
전환율(X)을 구할 수 있다.
flow rate(ml/min)가
⇒ 100(ml/min)일때, X = 1 - = 1 - = 0.58
∴ = = 1.38095
⇒ 150(ml/min)일때, X = 1 - = 1 - = 0.57
∴ = = 1.32558
⇒ 200(ml/min)일때, X = 1 - = 1 - = 0.54
∴ = = 1.17391
1-5. 반응상수 k값 구하기
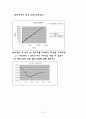
▶ 식에서 t() 과 을 plot하면 기울기가 Ck 인 값을 얻을수 있다.
우리가 얻고자 하는 게 k 이므로, 위 그래프에서 얻은 기울기와 Ck를 비교해서 k를 구할 수 있다.
⇒ 기울기 = Ck ⇒ 0.0394 = 0.05k ⇒ ∴ k = 0.788
1-6 . PFR의 부피를 두배로 늘렸을 경우
① k값의 변화
▶ 기존의 부피 V =960ml 이지만, 부피를 두 배로 늘렸으므로
V = 960 × 2 = 1920ml 가 된다. 그러면 t()가 변화하게 된다.
flow rate(ml/min)가
⇒ 100ml/min 일 때, t = = 19.2min
⇒ 150ml/min 일 때, t = = 12.8min
⇒ 200ml/min 일 때, t = = 9.6min 이 된다.
또, 식에서 t이 두 배씩 늘고 X/1-X는 반으로 줄게 된다.
즉, ⇒ ⇒
이 되게 된다.
flow rate(ml/min)
t
100
19.2
2.76190
150
12.8
2.65116
200
9.6
2.34782
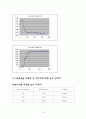
▶ 5번에서와 같이 기울기 = 가 된다.
즉, 0.0099 = 0.05k가 되므로 k = 0.789가 된다.
부피가 두 배가 되기 전의 k가 0.788이므로 부피가 두 배가 되더라도 k값에는 변화가 없음을 알 수 있다.
② 전환율(X)의 변화
▶ 부피가 두 배 일 때,
전환율(X)는 에서와 같이 가 두배로 늘어 나게 된다.
flow rate(ml/min)가
⇒ 100ml/min 일 때, = 2.76190 ⇒ ∴ X = 0.84
⇒ 150ml/min 일 때, = 2.65116 ⇒ ∴ X = 0.72
⇒ 200ml/min 일 때, = 2.34782 ⇒ ∴ X = 0.70이 된다.
다시 정리해 비교해보면
▶k값의 비교
V
960ml
1920ml
k
0.788
0.789
▶전환율의 비교
flow rate V
960ml
1920ml
100
0.58
0.84
150
0.57
0.72
200
0.54
0.70
2. 토론
이 번 실험은 Tubular reactor와 continuous stirred tank reactor (CSTR)를 이 용하여 반응속도 상수(k)를 결정하는 것이다.
실험에 앞서 시약을 제조하였다. 0.05M NaOH 20L와 0.05M CH3COOC2H5 20L 를 만들었다. 0.05M CH3COOC2H5 20L 제조법을 예로 들면 다음과 같다.
용액 제조 후 이 두 용액을 이용해 반응기에 주입시켜 실험방법에 입각해서 본 격적인 실험을 수행한다.
각각의 농도에서의 수산화나트륨의 전도도를 측정하여 검량선을 얻을 수 있었고, 유속을 달리하여 반응기에 흘려준 뒤 유속과 전도도의 값을 통하여 농도를 구할 수 있었다. 이 후 농도값을 통하여 체류시간과 전환율을 구한 후 궁극적으로 얻고 자 하는 반응속도 상수(k)를 구하였다.
아레니우스의 식 (온도가 화학반응속도에 미치는 효과를 수학적으로 나타낸 식)
K(T) = A exp(-Ea/RT)
(A : frequency factor, Ea : 활성화 에너지, R : 기체상수)
에 의하면 반응속도 상수(k)가 온도만의 함수라는 것을 알 수 있다. 실험을 통해
반응속도 상수(k)가 온도만의 함수라는걸 확인 할 수 있었다. 또, 반응기 부피를 두 배로 하더라도 반응속도 상수(k)에는 영향이 없었다.
실험은 등온이라는 조건으로 진행되었는데 이는 온도라는 변수 하나를 줄임으로 서 반응속도 상수(k)를 구하기 위함이다. 전환율은 유속이 증가 함에 따라 감소하 였다. 이는 유속이 빠를 수록 반응기 안에 체류시간이 짧아져서 전환율이 줄어든 것이다.
결론적으로, 반응속도 상수(k)는 온도만의 함수 이므로 그 외의 조건에서는 변화 하지 않는다. 아레니우스의 식(Arrhenius equation)을 증명할 수 있다. 또, 전환율 (X)은 반응기의 부피가 증가하면 늘어나지만, 유속이 증가하면 감소된다
Ⅴ. 결론
이 번 실험은 Tubular reactor와 continuous stirred tank reactor (CSTR)를 이용하여 반응속도 상수(k)를 결정하는 것이다. 실험 결과, 전환율(X)은 반응기의 부피에 비례하지만, 유속에는 반비례한다. 반응속도상수 k는 온도만의 함수 이므로 반응기의 부피변화와는 아무런 영향이 없다.
Ⅵ. 참고문헌
1. Elements of chemical reaction engineering, H.scott fogler, 1999 (CD)
2. 화학반응공학, 아진, 송승구외, 2000 3판
3. NAVER 백과사전
『C(mol/l)구하는 과정』
▶flow rate(ml/min)가
⇒ 100일때, 3150 = 145220X + 124.27 ⇒ X = 0.0208
⇒ 150일때, 3270 = 145220X + 124.27 ⇒ X = 0.0216
⇒ 200일때, 3490 = 145220X + 124.27 ⇒ X = 0.0232
1-4. t과 전환율(X) 구하기
▶t(residence time = ) 과 전환율(X)
flow rate(ml/min)
t()
100
9.6
1.38095
150
6.4
1.32558
200
4.8
1.17391
『t구하는 과정』
▶ t = 이고, V =960ml 이다.
그러므로 flow rate(ml/min)가
⇒ 100(ml/min) 일때, t = = 9.6min
⇒ 150(mi/min) 일때, t = = 6.4min
⇒ 200(ml/min) 일때, t = = 4.8min
『전환율(X) 구하는 과정』
▶ 온도, 부피, 압력이 일정할때,
C = C(1-X) ⇒ = 1-X ⇒ ∴ X = 1 -
그러므로 C와 C(초기농도 = 0.05M)를 알고 있으면
전환율(X)을 구할 수 있다.
flow rate(ml/min)가
⇒ 100(ml/min)일때, X = 1 - = 1 - = 0.58
∴ = = 1.38095
⇒ 150(ml/min)일때, X = 1 - = 1 - = 0.57
∴ = = 1.32558
⇒ 200(ml/min)일때, X = 1 - = 1 - = 0.54
∴ = = 1.17391
1-5. 반응상수 k값 구하기
▶ 식에서 t() 과 을 plot하면 기울기가 Ck 인 값을 얻을수 있다.
우리가 얻고자 하는 게 k 이므로, 위 그래프에서 얻은 기울기와 Ck를 비교해서 k를 구할 수 있다.
⇒ 기울기 = Ck ⇒ 0.0394 = 0.05k ⇒ ∴ k = 0.788
1-6 . PFR의 부피를 두배로 늘렸을 경우
① k값의 변화
▶ 기존의 부피 V =960ml 이지만, 부피를 두 배로 늘렸으므로
V = 960 × 2 = 1920ml 가 된다. 그러면 t()가 변화하게 된다.
flow rate(ml/min)가
⇒ 100ml/min 일 때, t = = 19.2min
⇒ 150ml/min 일 때, t = = 12.8min
⇒ 200ml/min 일 때, t = = 9.6min 이 된다.
또, 식에서 t이 두 배씩 늘고 X/1-X는 반으로 줄게 된다.
즉, ⇒ ⇒
이 되게 된다.
flow rate(ml/min)
t
100
19.2
2.76190
150
12.8
2.65116
200
9.6
2.34782
▶ 5번에서와 같이 기울기 = 가 된다.
즉, 0.0099 = 0.05k가 되므로 k = 0.789가 된다.
부피가 두 배가 되기 전의 k가 0.788이므로 부피가 두 배가 되더라도 k값에는 변화가 없음을 알 수 있다.
② 전환율(X)의 변화
▶ 부피가 두 배 일 때,
전환율(X)는 에서와 같이 가 두배로 늘어 나게 된다.
flow rate(ml/min)가
⇒ 100ml/min 일 때, = 2.76190 ⇒ ∴ X = 0.84
⇒ 150ml/min 일 때, = 2.65116 ⇒ ∴ X = 0.72
⇒ 200ml/min 일 때, = 2.34782 ⇒ ∴ X = 0.70이 된다.
다시 정리해 비교해보면
▶k값의 비교
V
960ml
1920ml
k
0.788
0.789
▶전환율의 비교
flow rate V
960ml
1920ml
100
0.58
0.84
150
0.57
0.72
200
0.54
0.70
2. 토론
이 번 실험은 Tubular reactor와 continuous stirred tank reactor (CSTR)를 이 용하여 반응속도 상수(k)를 결정하는 것이다.
실험에 앞서 시약을 제조하였다. 0.05M NaOH 20L와 0.05M CH3COOC2H5 20L 를 만들었다. 0.05M CH3COOC2H5 20L 제조법을 예로 들면 다음과 같다.
용액 제조 후 이 두 용액을 이용해 반응기에 주입시켜 실험방법에 입각해서 본 격적인 실험을 수행한다.
각각의 농도에서의 수산화나트륨의 전도도를 측정하여 검량선을 얻을 수 있었고, 유속을 달리하여 반응기에 흘려준 뒤 유속과 전도도의 값을 통하여 농도를 구할 수 있었다. 이 후 농도값을 통하여 체류시간과 전환율을 구한 후 궁극적으로 얻고 자 하는 반응속도 상수(k)를 구하였다.
아레니우스의 식 (온도가 화학반응속도에 미치는 효과를 수학적으로 나타낸 식)
K(T) = A exp(-Ea/RT)
(A : frequency factor, Ea : 활성화 에너지, R : 기체상수)
에 의하면 반응속도 상수(k)가 온도만의 함수라는 것을 알 수 있다. 실험을 통해
반응속도 상수(k)가 온도만의 함수라는걸 확인 할 수 있었다. 또, 반응기 부피를 두 배로 하더라도 반응속도 상수(k)에는 영향이 없었다.
실험은 등온이라는 조건으로 진행되었는데 이는 온도라는 변수 하나를 줄임으로 서 반응속도 상수(k)를 구하기 위함이다. 전환율은 유속이 증가 함에 따라 감소하 였다. 이는 유속이 빠를 수록 반응기 안에 체류시간이 짧아져서 전환율이 줄어든 것이다.
결론적으로, 반응속도 상수(k)는 온도만의 함수 이므로 그 외의 조건에서는 변화 하지 않는다. 아레니우스의 식(Arrhenius equation)을 증명할 수 있다. 또, 전환율 (X)은 반응기의 부피가 증가하면 늘어나지만, 유속이 증가하면 감소된다
Ⅴ. 결론
이 번 실험은 Tubular reactor와 continuous stirred tank reactor (CSTR)를 이용하여 반응속도 상수(k)를 결정하는 것이다. 실험 결과, 전환율(X)은 반응기의 부피에 비례하지만, 유속에는 반비례한다. 반응속도상수 k는 온도만의 함수 이므로 반응기의 부피변화와는 아무런 영향이 없다.
Ⅵ. 참고문헌
1. Elements of chemical reaction engineering, H.scott fogler, 1999 (CD)
2. 화학반응공학, 아진, 송승구외, 2000 3판
3. NAVER 백과사전








































소개글