목차
1.서론
2.이론 및 원리
3.실험기구 및 시약
4.실험방법
5.실험결과 및 고찰
6.참고문헌
2.이론 및 원리
3.실험기구 및 시약
4.실험방법
5.실험결과 및 고찰
6.참고문헌
본문내용
의 값이 이론적으로 계산 가능하게된다.
c. 3번형 등온선 (예 : 100oC에서 활성탄에 대한 수증기의 흡착)
비다공성 탄소 (non-porous carbon)에 대한 수증기의 흡착에서처럼 흡착되는 분자가 고체표면에 젖지(wetting)않을 때, 즉 접촉각이 90o보다 클 때 관찰되는 것으로 흡착열이 흡착질의 액화열보다 적을 때 나타나며, 매우 드문 형태로서 흡착 gas간의 상호 작용이 gas, solid간의 흡착력보다 큰 경우에 해당한다.
d. 4번형 등온선
15~1000Å의 기공반경을 갖는 흡착제에서 나타나며, knee부분은 2번형 등온선과 비슷한데, 일반적으로 이 부분에서 최초의 단분자층 흡착(monolayer adsorption)이 거의 끝난다. 중기공에 모세관 응축이 일어나는 경우이며 이 흡착등온선의 특징은 hysterisis loop인데 흡착 system에 따라 다른 여러 가지 형태의 등온선을 보이지만 항상 어떠한 상대압력에 있어서 흡착곡선보다 탈착곡선이 위에 있다.
e. 5번형 등온선
3번형 등온선과는 달리 흡착질-흡착제 사이의 상호작용력이 작은 경우에 일어나며 4번형 등온선과 같은 범위의 기공를 갖는 흡착제에서 나타난다.
f. 6번형 등온선
최근에 발견된 형태로 상대압력에 따라 흡착량이 계단식으로 변화되는 형태 모든 등온선에서 microporosity 가 존재하는 경우를 제외하고 탈착시 상대압력이 0.3에 도달하기전에 hystersis loops는 흡착선과 일치하게 된다.
7) 활성탄(흡착제)
① 활성탄
다공질로 흡착성이 강한 탄소질의 재. 목재. 갈탄. 토탄을 활성화제와 함께 건류하거나 목탄을 수증기로 활성화해 만든다. 야자나무 열매껍질로 만드는 야자껍질 활성탄은 유명하다. 분말상태와 입자상태가 있다. 탈취, 탈색 외에 오염물질의 흡착 제거에도 쓰인다.
[Figure 2.5] 활성탄의 분류
② 활성탄의 형태
a. 파쇄상 : 입자크기가 보통 3~80 mesh로써 불규칙한 형상이다.
b. 분말상 : 보통 100 mesh 이하의 입도임
c. 성형상 : 조립탄이라고도 함. 일정한 규격크기의 형상으로 구형, 원주형임.
d. 섬유상 : 의약용으로도 정제후 사용.
③ 활성탄의 용도
a. 기상용 : 공기 및 GAS중의 선택적 제거성분의 흡착
b. 액상용 : 물 및 액상물질중 선택적 성분의 제거
c. 촉매용 : 활성탄 특성을 활용한 촉매 및 간접담체로 활용
d. 기 타 : 의약용으로도 정제후 사용
[Figure 2.6] 활성탄소의 세공구조
3. 실험시약 및 기구
① 실험시약
0.1N 초산수용액, 페놀프탈레인 지시약, 0.05N NaOH 수용액, 활성탄
② 실험기구
항온진탕기 1대, 삼각 플라스크 10대
[Figure 3.1] 실제흡착실험장치
[Figure 3.2] 흡착실험장치
4. 실험방법
① 실험방법
a. 항온 진탕기(항온조) 온도를 30℃로 유지시킨다.
b. 0.1N 초산 500mL를 넣은 각각의 삼각플라스크에 활성탄을 0.005~0.6g씩 넣어 1시간동안 흡착시킨다.
c. 삼각플라스크 내 용액을 20mL 채취한 후 0.05N NaOH로 적정한다.
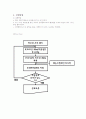
②Flow Chart
[Figure4.1] 흡착중인 항온조 속(좌), 항온조 온도조절(우)
5. 실험결과 및 고찰
① 결과
활성탄양
(g)
NaOH
적정양
(mL)
NaOH mol수
평형mol 농도 (mol/L)
흡착용량 q(mol/g)
ln C
ln q
0.05
58
0.145
0.058
-1.93
-2.85
0.1
45
0.1125
0.0225
-2.18
-3.79
0.2
43
0.1075
0.01075
-2.23
-4.53
0.3
42
0.105
0.007
-2.25
-4.96
0.4
41
0.1025
0.005125
-2.28
-5.27
0.5
40.5
0.10125
0.00405
-2.29
-5.51
0.6
37
0.0925
0.00308
-2.38
-5.78
② 고찰
본 실험은 일정한 농도, 일정한 온도에서 흡착제의 양을 변화시키면서 흡착되는 양을 측정하여 흡착 원리를 이해하고자 하는 실험이었다.
데이터를 계산해 보고 그래프를 그려보니 실험 결과값은 만족스럽게 나왔다.
Freundlich 흡착등온식은 으로 기울기가 1/n, y절편이 lnK인 식이다. 우리가 구한 데이터를 이용하여 회귀분석하면 기울기 1/n=6.98, y절편 lnK는 10.8이 나온다. 따라서 n = 0.143, K = 49020의 값이란걸 알 수 있었다. n의 값은 보통 1보다 크고, 1/n값이 0.1~0.5이면 흡착이 용이하게 일어나는 것인데 우리조의 실험에서는 n이 앞의 두가지 값에 모두 포함되지 않으므로 흡착이 용이하게 일어나지 않았다는 것을 알 수 있다. 그리고 그래프를 보면 약간의 오차가 발생하였는데 오차의 발생 원인에 대해 생각해보면 첫 번째로 적정할 때의 오차를 생각할 수 있다. 오차를 줄이기 위해 한사람에 계속해서 적정을 하였지만 색변화가 갑작스럽게 일어나서 그 순간을 정확히 맞출 수가 없었다. 또 다른 점을 생각해보면 시료의 문제를 생각해 보았다. 용액을 만들때 정확한 농도의 용액을 만들지 못하였거나 활성탄은 깨끗하고 완전히 건조된 것이여야 했는데 그렇지 못했던 것 같다. 물론 활성탄 시료의 무게 측정에서 오차가 일어 났을 수도 있다. 또 한가지 점을 더 있다고 한다면 흡착실험장치에 활성탄과 초산이 든 플라스크를 흡착 시키는 동안 플라스크를 처음에는 고정시키지 않아 이 플라스크가 모두 넘어졌었다. 이 때 약간의 물이 들어갔을 수도 있다.
6. 참고문헌
물리 화학 실험, 권오천, 형설출판사, 1983, pp 114~116
신형식, “화학공학 기초실험 (Laborotory Manual)\", 1st Edition, 전북대학교, 화학공학부, 전주, chapter 10
최규원, “분석화학”, 1st Edition, 박영사, 1992, pp.479-482
김광진, “동아대백과 사전”, 3rd Edition, vol. 30, 동아출판사, 1985, pp 461
물리 화학, P.W.ATKIS, 청문각, 1994, pp 946~948
김진일, “유기단위공정”, 2nd Edition, 보성문화사, 1993, pp325-326
c. 3번형 등온선 (예 : 100oC에서 활성탄에 대한 수증기의 흡착)
비다공성 탄소 (non-porous carbon)에 대한 수증기의 흡착에서처럼 흡착되는 분자가 고체표면에 젖지(wetting)않을 때, 즉 접촉각이 90o보다 클 때 관찰되는 것으로 흡착열이 흡착질의 액화열보다 적을 때 나타나며, 매우 드문 형태로서 흡착 gas간의 상호 작용이 gas, solid간의 흡착력보다 큰 경우에 해당한다.
d. 4번형 등온선
15~1000Å의 기공반경을 갖는 흡착제에서 나타나며, knee부분은 2번형 등온선과 비슷한데, 일반적으로 이 부분에서 최초의 단분자층 흡착(monolayer adsorption)이 거의 끝난다. 중기공에 모세관 응축이 일어나는 경우이며 이 흡착등온선의 특징은 hysterisis loop인데 흡착 system에 따라 다른 여러 가지 형태의 등온선을 보이지만 항상 어떠한 상대압력에 있어서 흡착곡선보다 탈착곡선이 위에 있다.
e. 5번형 등온선
3번형 등온선과는 달리 흡착질-흡착제 사이의 상호작용력이 작은 경우에 일어나며 4번형 등온선과 같은 범위의 기공를 갖는 흡착제에서 나타난다.
f. 6번형 등온선
최근에 발견된 형태로 상대압력에 따라 흡착량이 계단식으로 변화되는 형태 모든 등온선에서 microporosity 가 존재하는 경우를 제외하고 탈착시 상대압력이 0.3에 도달하기전에 hystersis loops는 흡착선과 일치하게 된다.
7) 활성탄(흡착제)
① 활성탄
다공질로 흡착성이 강한 탄소질의 재. 목재. 갈탄. 토탄을 활성화제와 함께 건류하거나 목탄을 수증기로 활성화해 만든다. 야자나무 열매껍질로 만드는 야자껍질 활성탄은 유명하다. 분말상태와 입자상태가 있다. 탈취, 탈색 외에 오염물질의 흡착 제거에도 쓰인다.
[Figure 2.5] 활성탄의 분류
② 활성탄의 형태
a. 파쇄상 : 입자크기가 보통 3~80 mesh로써 불규칙한 형상이다.
b. 분말상 : 보통 100 mesh 이하의 입도임
c. 성형상 : 조립탄이라고도 함. 일정한 규격크기의 형상으로 구형, 원주형임.
d. 섬유상 : 의약용으로도 정제후 사용.
③ 활성탄의 용도
a. 기상용 : 공기 및 GAS중의 선택적 제거성분의 흡착
b. 액상용 : 물 및 액상물질중 선택적 성분의 제거
c. 촉매용 : 활성탄 특성을 활용한 촉매 및 간접담체로 활용
d. 기 타 : 의약용으로도 정제후 사용
[Figure 2.6] 활성탄소의 세공구조
3. 실험시약 및 기구
① 실험시약
0.1N 초산수용액, 페놀프탈레인 지시약, 0.05N NaOH 수용액, 활성탄
② 실험기구
항온진탕기 1대, 삼각 플라스크 10대
[Figure 3.1] 실제흡착실험장치
[Figure 3.2] 흡착실험장치
4. 실험방법
① 실험방법
a. 항온 진탕기(항온조) 온도를 30℃로 유지시킨다.
b. 0.1N 초산 500mL를 넣은 각각의 삼각플라스크에 활성탄을 0.005~0.6g씩 넣어 1시간동안 흡착시킨다.
c. 삼각플라스크 내 용액을 20mL 채취한 후 0.05N NaOH로 적정한다.
②Flow Chart
[Figure4.1] 흡착중인 항온조 속(좌), 항온조 온도조절(우)
5. 실험결과 및 고찰
① 결과
활성탄양
(g)
NaOH
적정양
(mL)
NaOH mol수
평형mol 농도 (mol/L)
흡착용량 q(mol/g)
ln C
ln q
0.05
58
0.145
0.058
-1.93
-2.85
0.1
45
0.1125
0.0225
-2.18
-3.79
0.2
43
0.1075
0.01075
-2.23
-4.53
0.3
42
0.105
0.007
-2.25
-4.96
0.4
41
0.1025
0.005125
-2.28
-5.27
0.5
40.5
0.10125
0.00405
-2.29
-5.51
0.6
37
0.0925
0.00308
-2.38
-5.78
② 고찰
본 실험은 일정한 농도, 일정한 온도에서 흡착제의 양을 변화시키면서 흡착되는 양을 측정하여 흡착 원리를 이해하고자 하는 실험이었다.
데이터를 계산해 보고 그래프를 그려보니 실험 결과값은 만족스럽게 나왔다.
Freundlich 흡착등온식은 으로 기울기가 1/n, y절편이 lnK인 식이다. 우리가 구한 데이터를 이용하여 회귀분석하면 기울기 1/n=6.98, y절편 lnK는 10.8이 나온다. 따라서 n = 0.143, K = 49020의 값이란걸 알 수 있었다. n의 값은 보통 1보다 크고, 1/n값이 0.1~0.5이면 흡착이 용이하게 일어나는 것인데 우리조의 실험에서는 n이 앞의 두가지 값에 모두 포함되지 않으므로 흡착이 용이하게 일어나지 않았다는 것을 알 수 있다. 그리고 그래프를 보면 약간의 오차가 발생하였는데 오차의 발생 원인에 대해 생각해보면 첫 번째로 적정할 때의 오차를 생각할 수 있다. 오차를 줄이기 위해 한사람에 계속해서 적정을 하였지만 색변화가 갑작스럽게 일어나서 그 순간을 정확히 맞출 수가 없었다. 또 다른 점을 생각해보면 시료의 문제를 생각해 보았다. 용액을 만들때 정확한 농도의 용액을 만들지 못하였거나 활성탄은 깨끗하고 완전히 건조된 것이여야 했는데 그렇지 못했던 것 같다. 물론 활성탄 시료의 무게 측정에서 오차가 일어 났을 수도 있다. 또 한가지 점을 더 있다고 한다면 흡착실험장치에 활성탄과 초산이 든 플라스크를 흡착 시키는 동안 플라스크를 처음에는 고정시키지 않아 이 플라스크가 모두 넘어졌었다. 이 때 약간의 물이 들어갔을 수도 있다.
6. 참고문헌
물리 화학 실험, 권오천, 형설출판사, 1983, pp 114~116
신형식, “화학공학 기초실험 (Laborotory Manual)\", 1st Edition, 전북대학교, 화학공학부, 전주, chapter 10
최규원, “분석화학”, 1st Edition, 박영사, 1992, pp.479-482
김광진, “동아대백과 사전”, 3rd Edition, vol. 30, 동아출판사, 1985, pp 461
물리 화학, P.W.ATKIS, 청문각, 1994, pp 946~948
김진일, “유기단위공정”, 2nd Edition, 보성문화사, 1993, pp325-326





































소개글