목차
5-1. 여과 (filtration)
1. 여과의 분류
5-2. 막분리 (membrane seperation)
1. 막 (membrane)의 정의
2. 막의 분류
3. 막의 특성 및 분류
4. 막을 이용한 분리공정
5-3. 막을 통과하는 입자의 크기를 이용한 분리공정
1. 미세여과 (microfiltration)
2. 한외여과 (ultrafiltration)
3. 역삼투(reverse osmosis)
5-4. 막을 통한 확산속도의 차이를 이용한 분리공정
1. 기체분리
1) 다공질막(porous membrane)을 통한 기체투과
2) 비다공질막(nonporous membrane)을 통한 기체 투과
2. 액체분리
1) 투과증발(pervaporation)
2) 투석 (dialysis)
1. 여과의 분류
5-2. 막분리 (membrane seperation)
1. 막 (membrane)의 정의
2. 막의 분류
3. 막의 특성 및 분류
4. 막을 이용한 분리공정
5-3. 막을 통과하는 입자의 크기를 이용한 분리공정
1. 미세여과 (microfiltration)
2. 한외여과 (ultrafiltration)
3. 역삼투(reverse osmosis)
5-4. 막을 통한 확산속도의 차이를 이용한 분리공정
1. 기체분리
1) 다공질막(porous membrane)을 통한 기체투과
2) 비다공질막(nonporous membrane)을 통한 기체 투과
2. 액체분리
1) 투과증발(pervaporation)
2) 투석 (dialysis)
본문내용
70년대 오일쇼크이후 대체연료로 에탄올이 부각됨에 따라 그 중요성이 인식되었다.
(2) 투과 증발의 이론
투과증발의 기본 메카니즘은 고분자막의 공급쪽에서 액체 혼합물의 수착, 고분자막을 통한 확산, 고분자막의 기상쪽에서 통과한 물질의 탈착으로 요약할 수 있다. 고분자막에 있어 수착과 확산은 확산되는 성분의 이동속도에 영향을 미친다. 확산계수와 용해도는 조성의 영향을 크게 받는다. 막을 통한 물질이동의 추진력은 막 사이의 화학포텐셜의 차이 때문에 생기며 화학포텐셜은 아래와 같이 나타낼 수 있다.
(5-18)
여기서 는 표준 화학퍼텐셜, ai 는 막을 통과하는 성분의 활동도, R은 기체 상수이고
T는 절대온도이다.
i 성분의 활동도는 아래와 같이 표현된다.
(5-19)
여기서 는 i 성분의 포화 증기압이고 Pi 는 증기압이다. 다성분 혼합물에 있어서 성분활동도는 아래로 표시된다.
(5-20)
다성분 혼합물의 분리에 대한 투과증발 과정을 나타내기 위해서는 순수성분의 확산 단계에 대해서 생각해 보아야 되는데 이것은 Fick의 법칙으로 설명된다. 이것은 막을 통한 액체의 확산속도를 나타내는 식이다.
(5-21)
여기서 Ji 는 flux, Di는 확산계수, ci는 막 내에서의 농도이며 l 은 막을 통과하는 거리이다.
(5-22)
여기서 Di 는 매우 옅은 농도에서 확산계수이고, Ai 는 투과물과 고분자의 상호작용에 대한
플라스틱 계수이다. .
만일 Ai ≤ 0 이라면 다음식으로 확산계수와 농도사이 관계식이 근사되어질수 있다.
(5-23)
5-22식을 5-21식에 대입해서 적분하면 다음식이 나온다.
(5-24)
여기서 cif 와 cip 는 각각 막에서 공급(feed)측과 투과된 측(permeate)의 성분 농도를 나타낸다. 투과증발이 진공 상태 또는 감압된 상태에서 행해질 때 cip는 0에 가까와 진다. 그래서 위의 식은 다음과 같이 나타낼 수 있다.
(5-25)
주어진 액체-고분자 계에서 확산계수 Dio, 플라스틱 계수 Ai 그리고 막의 두께 l 은 모두 일정한 값이다. 막의 공급측에서 침투 성분의 농도는 물질의 이동에 많은 영향을 준다. 따라서 위의 식을 보면 물질의 투과속도는 투과물질의 용해도 및 확산속도에 의해 결정된다는 것을 알수 있다.
투과증발의 물질의 선택도(α)는 아래의 식으로 나타내어 진다.
(5-26)
여기서 XA, XB 는 공급측(액상)의 몰분율이고, YA, YB 는 투과측(기상)의 몰분율이다.
(3) 투과증발법의 공업적 응용
투과증발은 약 5-15% 물을 함유한 알콜의 탈수과정에 가장 흔히 사용되며 이때 물 선택적인 막(water-selective membrane)이 사용된다. 물과 유기물은 각각 서로 다른 극성을 띠어서 막에 대한 투과성이 서로 다르기 때문에 분리될수 있다. 발효액중 에탄올의 농도가 5-10% 정도로
낮을 때는 증류과정에 의해 에탄올을 농축할 수 있으나 에탄올의 농도가 95.6wt%에서는 물과 공비혼합물을 형성되므로 증류는 물을 제거하는데 비효과적이다.
두 번째 응용은 물에서 소량의 유기화합물을 제거하는 경우인데 유기화합물의 농도가 매우 낮다면 유기화합물의 제거가 물의 제거보다 경제적으로 유리하므로 용매선택적인 막(solvent selective membrane)을 사용하여 물에서 유기물을 분리한다. 용매선택적 막의 재질은 rubbery polymer, silicone rubber, polydimethylsiloxane, polybutadiene, natural rubber, polyether copolymers등이다. 이런 분리막은 benzene, 1,1,2-trichloroethane chloroform같은 휘발 소수성 유기물에 대해 높은 선택도를 가진다.
투과증발을 생물공학에 응용한 예는 에탄올 또는 부탄올발효에서 발효용액부터 생성된 에탄올과 부탄올을 제거함으로써 알콜이 미생물의 생장을 억제하는 것을 막아 생산성을 증가시키는 것이다.
2) 투석 (dialysis)
(1) 투석의 개요
투석은 다공질막을 통하여 사용하여 용액으로부터 작은분자량을 가진 용질이 낮은 농도영역으로 확산하여 선택적으로 분리되는 공정이다. 이때 막을 통한 압력차는 거의 없으며 각 용질의 플럭스는 농도차에 비례한다. 분자량이 큰 용질은 대개 공급 용액 중에 잔류하는데 그 이유는 이들은 확산도가 낮고 또 작은 세공에서 이런 분자들의 확산은 크게 방해받기 때문이다. 투석중 대표적인 것이 전기투석(electrodialysis)이다. 전기투석은 전하를 띤 이온교환막을 이용하게 되는데 이 이온교환막은 양이온 또는 음이온교환기를 가진 얇은층으로 되어있어 양이온교환막은 양이온만 투과시키고, 음이온교환막은 음이온만 투과시켜 분리가 일어나게 된다.
(2) 투석의 이론
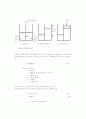
투석은 얇은 다공질막을 사용하여 용액으로부터 저분자량 용질이 저농도영역으로 확산하도록 하여 선택적으로 분리해내는 방법이다. 전형적 투석공정에서 농도구배를 그림13에서 나타내었다.
막 중에서 CA와 CB의 값은 세공 유체중의 농도이지 막 전체 부피에 기준한 농도가 아니며, 콜로이드 입자는 세공 크기보다 크므로 세공내의 유체와 생성물에서 CC = 0이다. 용질 플럭스에 관한 식은 물질전달에 대한 세 가지 저항(원료측 경계층의 저항, 막의 저항, 제품측 경계층의 저항)을 고려한다.
(5-27)
(5-28)
공급물과 생성물에 대한 계수 K1A , K2A는 유량, 물성, 막구조에 따라 다르며, 막에 대한 계수 Km 은 유효확산도 De 에 비례하고, 막두께 Z에 반비례한다.
(2) 투석의 응용
투석은 신장병이 있는 사람의 혈액으로부터 노폐물을 제거하는 인공신장에 가장 잘 응용되어있다. 요소를 비롯한 저분자가 막을 통하여 외부 용액으로 확산되며, 단백질과 세포는 혈액 중에 잔류한다. 투석의 공업적 응용은 비스코오스법으로 인조견을 만들때 생성되는 헤미셀룰로오스 용액으로부터 가성소다를 회수하는 것이다. 또 투석법을 이용하여 천연 생성물이나 콜로이드용액으로부터 소금이나 설탕을 회수할수도 있다. 전기투석를 대규모로 응용할 때는 이온 선택성 막을 사용하며, 전위구배에 의해 막을 통한 이온의 이동을 촉진시킨다.
(2) 투과 증발의 이론
투과증발의 기본 메카니즘은 고분자막의 공급쪽에서 액체 혼합물의 수착, 고분자막을 통한 확산, 고분자막의 기상쪽에서 통과한 물질의 탈착으로 요약할 수 있다. 고분자막에 있어 수착과 확산은 확산되는 성분의 이동속도에 영향을 미친다. 확산계수와 용해도는 조성의 영향을 크게 받는다. 막을 통한 물질이동의 추진력은 막 사이의 화학포텐셜의 차이 때문에 생기며 화학포텐셜은 아래와 같이 나타낼 수 있다.
(5-18)
여기서 는 표준 화학퍼텐셜, ai 는 막을 통과하는 성분의 활동도, R은 기체 상수이고
T는 절대온도이다.
i 성분의 활동도는 아래와 같이 표현된다.
(5-19)
여기서 는 i 성분의 포화 증기압이고 Pi 는 증기압이다. 다성분 혼합물에 있어서 성분활동도는 아래로 표시된다.
(5-20)
다성분 혼합물의 분리에 대한 투과증발 과정을 나타내기 위해서는 순수성분의 확산 단계에 대해서 생각해 보아야 되는데 이것은 Fick의 법칙으로 설명된다. 이것은 막을 통한 액체의 확산속도를 나타내는 식이다.
(5-21)
여기서 Ji 는 flux, Di는 확산계수, ci는 막 내에서의 농도이며 l 은 막을 통과하는 거리이다.
(5-22)
여기서 Di 는 매우 옅은 농도에서 확산계수이고, Ai 는 투과물과 고분자의 상호작용에 대한
플라스틱 계수이다. .
만일 Ai ≤ 0 이라면 다음식으로 확산계수와 농도사이 관계식이 근사되어질수 있다.
(5-23)
5-22식을 5-21식에 대입해서 적분하면 다음식이 나온다.
(5-24)
여기서 cif 와 cip 는 각각 막에서 공급(feed)측과 투과된 측(permeate)의 성분 농도를 나타낸다. 투과증발이 진공 상태 또는 감압된 상태에서 행해질 때 cip는 0에 가까와 진다. 그래서 위의 식은 다음과 같이 나타낼 수 있다.
(5-25)
주어진 액체-고분자 계에서 확산계수 Dio, 플라스틱 계수 Ai 그리고 막의 두께 l 은 모두 일정한 값이다. 막의 공급측에서 침투 성분의 농도는 물질의 이동에 많은 영향을 준다. 따라서 위의 식을 보면 물질의 투과속도는 투과물질의 용해도 및 확산속도에 의해 결정된다는 것을 알수 있다.
투과증발의 물질의 선택도(α)는 아래의 식으로 나타내어 진다.
(5-26)
여기서 XA, XB 는 공급측(액상)의 몰분율이고, YA, YB 는 투과측(기상)의 몰분율이다.
(3) 투과증발법의 공업적 응용
투과증발은 약 5-15% 물을 함유한 알콜의 탈수과정에 가장 흔히 사용되며 이때 물 선택적인 막(water-selective membrane)이 사용된다. 물과 유기물은 각각 서로 다른 극성을 띠어서 막에 대한 투과성이 서로 다르기 때문에 분리될수 있다. 발효액중 에탄올의 농도가 5-10% 정도로
낮을 때는 증류과정에 의해 에탄올을 농축할 수 있으나 에탄올의 농도가 95.6wt%에서는 물과 공비혼합물을 형성되므로 증류는 물을 제거하는데 비효과적이다.
두 번째 응용은 물에서 소량의 유기화합물을 제거하는 경우인데 유기화합물의 농도가 매우 낮다면 유기화합물의 제거가 물의 제거보다 경제적으로 유리하므로 용매선택적인 막(solvent selective membrane)을 사용하여 물에서 유기물을 분리한다. 용매선택적 막의 재질은 rubbery polymer, silicone rubber, polydimethylsiloxane, polybutadiene, natural rubber, polyether copolymers등이다. 이런 분리막은 benzene, 1,1,2-trichloroethane chloroform같은 휘발 소수성 유기물에 대해 높은 선택도를 가진다.
투과증발을 생물공학에 응용한 예는 에탄올 또는 부탄올발효에서 발효용액부터 생성된 에탄올과 부탄올을 제거함으로써 알콜이 미생물의 생장을 억제하는 것을 막아 생산성을 증가시키는 것이다.
2) 투석 (dialysis)
(1) 투석의 개요
투석은 다공질막을 통하여 사용하여 용액으로부터 작은분자량을 가진 용질이 낮은 농도영역으로 확산하여 선택적으로 분리되는 공정이다. 이때 막을 통한 압력차는 거의 없으며 각 용질의 플럭스는 농도차에 비례한다. 분자량이 큰 용질은 대개 공급 용액 중에 잔류하는데 그 이유는 이들은 확산도가 낮고 또 작은 세공에서 이런 분자들의 확산은 크게 방해받기 때문이다. 투석중 대표적인 것이 전기투석(electrodialysis)이다. 전기투석은 전하를 띤 이온교환막을 이용하게 되는데 이 이온교환막은 양이온 또는 음이온교환기를 가진 얇은층으로 되어있어 양이온교환막은 양이온만 투과시키고, 음이온교환막은 음이온만 투과시켜 분리가 일어나게 된다.
(2) 투석의 이론
투석은 얇은 다공질막을 사용하여 용액으로부터 저분자량 용질이 저농도영역으로 확산하도록 하여 선택적으로 분리해내는 방법이다. 전형적 투석공정에서 농도구배를 그림13에서 나타내었다.
막 중에서 CA와 CB의 값은 세공 유체중의 농도이지 막 전체 부피에 기준한 농도가 아니며, 콜로이드 입자는 세공 크기보다 크므로 세공내의 유체와 생성물에서 CC = 0이다. 용질 플럭스에 관한 식은 물질전달에 대한 세 가지 저항(원료측 경계층의 저항, 막의 저항, 제품측 경계층의 저항)을 고려한다.
(5-27)
(5-28)
공급물과 생성물에 대한 계수 K1A , K2A는 유량, 물성, 막구조에 따라 다르며, 막에 대한 계수 Km 은 유효확산도 De 에 비례하고, 막두께 Z에 반비례한다.
(2) 투석의 응용
투석은 신장병이 있는 사람의 혈액으로부터 노폐물을 제거하는 인공신장에 가장 잘 응용되어있다. 요소를 비롯한 저분자가 막을 통하여 외부 용액으로 확산되며, 단백질과 세포는 혈액 중에 잔류한다. 투석의 공업적 응용은 비스코오스법으로 인조견을 만들때 생성되는 헤미셀룰로오스 용액으로부터 가성소다를 회수하는 것이다. 또 투석법을 이용하여 천연 생성물이나 콜로이드용액으로부터 소금이나 설탕을 회수할수도 있다. 전기투석를 대규모로 응용할 때는 이온 선택성 막을 사용하며, 전위구배에 의해 막을 통한 이온의 이동을 촉진시킨다.














































소개글