목차
글리신산 니켈 (II) 착물의 안정도 상수
◆ ABSTRACT
◆ 이 론
1. 안정도 상수
2. Ni²⁺글리신 계
3. 안정도 상수를 실험으로 구하는 방법
◆ 시약 및 기기
◆ 실험 결과 및 고찰
◆ 결 론
◆ ABSTRACT
◆ 이 론
1. 안정도 상수
2. Ni²⁺글리신 계
3. 안정도 상수를 실험으로 구하는 방법
◆ 시약 및 기기
◆ 실험 결과 및 고찰
◆ 결 론
본문내용
pH
0
5.63
3.50
11.97
0.25
8.57
3.75
12.09
0.50
9.40
4.00
12.26
0.75
9.71
4.25
12.29
1.00
9.93
4.50
12.35
1.25
10.12
4.75
12.40
1.50
10.26
5.00
12.46
1.75
10.45
5.25
12.50
2.00
10.59
5.50
12.54
2.25
10.73
5.75
12.58
2.50
10.94
6.00
12.61
2.75
11.15
6.50
12.63
3.00
11.45
7.00
12.66
3.25
11.76
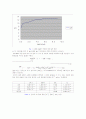
Fig 2. 0.5M NaOH 적정에 따른 pH 변화
※ 위 그래프에서 약 pH 8정도와 pH 11정도에서 두개의 변곡점이 나타났다.
적정액 1㎖와 5㎖ 사이의 범위에서 4점을 선택해서 식 (15)와 식 (16)을 이용하여 각 점에 대한 과 [gly-]을 한다.
----------(15)
------(16)
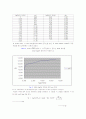
[Ni02+]는 용액에서 Ni2+의 초기 농도이다. 임의의 1㎖, 2㎖, 4㎖, 5㎖에서의 과 [gly-]의 값은 다음 표와 같다.
NaOH(㎖)
pH
[gly-]
log[gly-]
1.0
9.93
1.0×10-4
4
8.04
2.0
10.59
3.6×10-4
3.44
3.49
4.0
12.26
0.022
1.66
0.39
5.0
12.46
Table 4. 임의의 세 점에서의 [gly-], log[gly-], 의 값
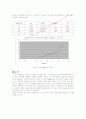
Fig 3. n vs log[gly-] 그래프
◆ 결 론
이 번 실험에서는 글리신의 안정화 상수를 구하는 것이 목적으로 금속이온이 존재하지 않는 글리신 용액을 NaOH로 적정하여 Ka값을 구한 후 이것을 이용하여 [gly-]와 금속이온 하나당 결합하는 분자의 평균수를 구한다. 그 후에 log[gly-]와 n에 관한 그래프로 나타낸 뒤 이 기울기를 이용하여 글리신의 안정화 상수를 구하는 것이다. Ni2+ 이온의 초기 농도[Ni02+] 및 글리신의 초기 농도[gly H0]와 글리신의 Ka값, 그리고 평형에서의 pH 등을 알고 이것을 이용하여 구한 안정도 상수는 다음과 같은 값을 가진다. n=1/2일 때 K1=1/[gly-]이다. 실제로 측정한 실험 값에서는 정확한 기울기를 알 수가 없었고, 따라서 글리신의 정확한 안정도 상수 역시 얻을 수가 없었다.
하지만 n=1/2와 같이 비슷한 방법으로 n =1 1/2이거나 n=2 1/2일 때를 이용하여 K2, K3를 추정할 수 있다.
0
5.63
3.50
11.97
0.25
8.57
3.75
12.09
0.50
9.40
4.00
12.26
0.75
9.71
4.25
12.29
1.00
9.93
4.50
12.35
1.25
10.12
4.75
12.40
1.50
10.26
5.00
12.46
1.75
10.45
5.25
12.50
2.00
10.59
5.50
12.54
2.25
10.73
5.75
12.58
2.50
10.94
6.00
12.61
2.75
11.15
6.50
12.63
3.00
11.45
7.00
12.66
3.25
11.76
Fig 2. 0.5M NaOH 적정에 따른 pH 변화
※ 위 그래프에서 약 pH 8정도와 pH 11정도에서 두개의 변곡점이 나타났다.
적정액 1㎖와 5㎖ 사이의 범위에서 4점을 선택해서 식 (15)와 식 (16)을 이용하여 각 점에 대한 과 [gly-]을 한다.
----------(15)
------(16)
[Ni02+]는 용액에서 Ni2+의 초기 농도이다. 임의의 1㎖, 2㎖, 4㎖, 5㎖에서의 과 [gly-]의 값은 다음 표와 같다.
NaOH(㎖)
pH
[gly-]
log[gly-]
1.0
9.93
1.0×10-4
4
8.04
2.0
10.59
3.6×10-4
3.44
3.49
4.0
12.26
0.022
1.66
0.39
5.0
12.46
Table 4. 임의의 세 점에서의 [gly-], log[gly-], 의 값
Fig 3. n vs log[gly-] 그래프
◆ 결 론
이 번 실험에서는 글리신의 안정화 상수를 구하는 것이 목적으로 금속이온이 존재하지 않는 글리신 용액을 NaOH로 적정하여 Ka값을 구한 후 이것을 이용하여 [gly-]와 금속이온 하나당 결합하는 분자의 평균수를 구한다. 그 후에 log[gly-]와 n에 관한 그래프로 나타낸 뒤 이 기울기를 이용하여 글리신의 안정화 상수를 구하는 것이다. Ni2+ 이온의 초기 농도[Ni02+] 및 글리신의 초기 농도[gly H0]와 글리신의 Ka값, 그리고 평형에서의 pH 등을 알고 이것을 이용하여 구한 안정도 상수는 다음과 같은 값을 가진다. n=1/2일 때 K1=1/[gly-]이다. 실제로 측정한 실험 값에서는 정확한 기울기를 알 수가 없었고, 따라서 글리신의 정확한 안정도 상수 역시 얻을 수가 없었다.
하지만 n=1/2와 같이 비슷한 방법으로 n =1 1/2이거나 n=2 1/2일 때를 이용하여 K2, K3를 추정할 수 있다.