목차
1. 실험 목적
2. 바탕 이론
3. 실험 기기 및 시약
4. 실험 방법
5. 참고문헌
2. 바탕 이론
3. 실험 기기 및 시약
4. 실험 방법
5. 참고문헌
본문내용
’s law라 한다. 묽은 용액의 삼투압은 용매나 용질의 종류와 관계없이 용액의 몰농도와 절대온도에 비례한다.
다음으로 인 경우는 전해질 용액의 경우이다. 전해질이 수용액 속에서 이온으로 녹는 경우와 약한 전해질인 경우에는 희석함에 따라서 이온화도가 증가한다.
마지막으로 인 경우는 비전해질 용액과 전해질,무극성 용매 용액에서 회합이 이루어지는 경우이다.
이를 통해 반트호프의 계수는 용질의 특성에 따라 값이 달라진다는 것을 알 수 있다. 용액의 삼투압을 측정해 Van’t Hoff’s law을 이용하면 고분자물질의 분자량을 측정할 수 있다. 분자량이 인 비휘발성, 비전해질인 용질 g이 녹아 있는 용액 L 속에 용질이 mol 들어 있다면 몰농도 ()는 이고, 몰수 ()는 이기 때문에 Van’t Hoff’s law에 각 값을 대입해 분자량 을 다음과 같이 구할 수 있다.
(9) 전해질 용액의 총괄성
- 용질과 용질사이와 용매와 용매사이, 용매와 용질 사이의 인력이 같은 용액을 이상 용액이라고 하는데, 이러한 이상 용액에서 \'용액의 총괄성\'이라는 것이 성립한다. 이상용액의 조건을 만족시키면, 용질의 종류와는 상관없이 용질의 양, 즉 농도에 따라 용액의 성질이 결정된다. 이는 ① 증기압 내림, ② 끓는점 오름, ③ 어는점 내림, ④ 삼투압 현상 위 네 가지 특성의 원인이 된다. 총괄성은 분자량을 결정하는데 이용된다. 순수한 용매에서의 증기압 내림이나 끓는점 오름의 성질을 측정하고 일정한 농도의 용질을 첨가한 용액에서 같은 성질들을 측정하고 비교해서 비휘발성 용질의 분자량을 알아낼 수 있기 때문이다. 고분자 물질의 분자량을 구할 때는 삼투압을 이용한다. 4가지 전해질 용액의 총괄성 중 이번 실험에서 주로 다루게 될 특성은 삼투압이다.
3. 실험 기기 및 시약
(1) 실험 기기
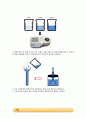
① 당도계
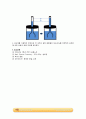
② 간이 삼투압계
- 깔때기의 관과 통의 안에 각각 농도가 다른 용액을 넣고 깔대기의 관에 반투과성 막을 붙인다. 그리고 반투과성 막을 통해 농도가 낮은 쪽에서 높은 쪽으로 물분자가 이동하여 생기는 높이차로 삼투현상을 관찰할 수 있다.
Fig 6. 간이 삼투압계
③ 고무줄
Fig 7. 고무줄
④ 반투과성 막 (셀로판지)
Fig 8. 셀로판지
(2) 실험 시약
① 백설탕
Fig 8. 백설탕의 분자구조
- 성상: 고체, 색상: 백색
- 녹는점/어는점 : 154 ℃
- 초기 끓는점과 끓는점 범위 : 331 ℃
- 비중: 1.525
- 분자량: 150.13
★ 폐시약의 처리
- 설탕물: 유기 폐기물로 처리해준다.
4. 실험 방법
1. 설탕을 이용하여 다양한 농도(임의의 농도)의 설탕 용액을 만든다. (1, 10, 20 wt%)
2. 당도계를 이용하여 각 설탕 용액의 당도(Brix)를 측정하고, 몰농도(mol/L)를 계산하여 삼투압을 구한다.
Sample
증류수 (ml)
설탕 (g)
당도 (Brix)
설탕 몰수 (mol)
몰농도 (mol/L)
1
2
3. 깔대기관의 한 쪽을 손으로 막고 눈금이 보일 정도까지 설탕 용액을 채우고, 반투과성 막을 고무줄로 막는다. (반투과성 막이 찢어지지 않도록 주의한다.)
4. 간이 삼투압계에 깔때기관의 아랫부분이 잠길 만큼 증류수로 채워준다.
5. 시간에 따른 눈금의 상승 정도를 기록하고 예측된 계산 결과와 비교한다.
6. 당도계를 이용하여 반투과성 막 내부의 설탕 혼합물의 당도(Brix)를 측정하여 삼투압에 의한 반응의 완결 여부를 판단한다.
5. 참고문헌
[1] 2018년도 2학년 2학기 실험노트
[2] Basic Physical Chemistry , 207p-209p -삼투압
[3] MSDS-설탕
[4] 위키피디아- 용매와 용질, 삼투
다음으로 인 경우는 전해질 용액의 경우이다. 전해질이 수용액 속에서 이온으로 녹는 경우와 약한 전해질인 경우에는 희석함에 따라서 이온화도가 증가한다.
마지막으로 인 경우는 비전해질 용액과 전해질,무극성 용매 용액에서 회합이 이루어지는 경우이다.
이를 통해 반트호프의 계수는 용질의 특성에 따라 값이 달라진다는 것을 알 수 있다. 용액의 삼투압을 측정해 Van’t Hoff’s law을 이용하면 고분자물질의 분자량을 측정할 수 있다. 분자량이 인 비휘발성, 비전해질인 용질 g이 녹아 있는 용액 L 속에 용질이 mol 들어 있다면 몰농도 ()는 이고, 몰수 ()는 이기 때문에 Van’t Hoff’s law에 각 값을 대입해 분자량 을 다음과 같이 구할 수 있다.
(9) 전해질 용액의 총괄성
- 용질과 용질사이와 용매와 용매사이, 용매와 용질 사이의 인력이 같은 용액을 이상 용액이라고 하는데, 이러한 이상 용액에서 \'용액의 총괄성\'이라는 것이 성립한다. 이상용액의 조건을 만족시키면, 용질의 종류와는 상관없이 용질의 양, 즉 농도에 따라 용액의 성질이 결정된다. 이는 ① 증기압 내림, ② 끓는점 오름, ③ 어는점 내림, ④ 삼투압 현상 위 네 가지 특성의 원인이 된다. 총괄성은 분자량을 결정하는데 이용된다. 순수한 용매에서의 증기압 내림이나 끓는점 오름의 성질을 측정하고 일정한 농도의 용질을 첨가한 용액에서 같은 성질들을 측정하고 비교해서 비휘발성 용질의 분자량을 알아낼 수 있기 때문이다. 고분자 물질의 분자량을 구할 때는 삼투압을 이용한다. 4가지 전해질 용액의 총괄성 중 이번 실험에서 주로 다루게 될 특성은 삼투압이다.
3. 실험 기기 및 시약
(1) 실험 기기
① 당도계
② 간이 삼투압계
- 깔때기의 관과 통의 안에 각각 농도가 다른 용액을 넣고 깔대기의 관에 반투과성 막을 붙인다. 그리고 반투과성 막을 통해 농도가 낮은 쪽에서 높은 쪽으로 물분자가 이동하여 생기는 높이차로 삼투현상을 관찰할 수 있다.
Fig 6. 간이 삼투압계
③ 고무줄
Fig 7. 고무줄
④ 반투과성 막 (셀로판지)
Fig 8. 셀로판지
(2) 실험 시약
① 백설탕
Fig 8. 백설탕의 분자구조
- 성상: 고체, 색상: 백색
- 녹는점/어는점 : 154 ℃
- 초기 끓는점과 끓는점 범위 : 331 ℃
- 비중: 1.525
- 분자량: 150.13
★ 폐시약의 처리
- 설탕물: 유기 폐기물로 처리해준다.
4. 실험 방법
1. 설탕을 이용하여 다양한 농도(임의의 농도)의 설탕 용액을 만든다. (1, 10, 20 wt%)
2. 당도계를 이용하여 각 설탕 용액의 당도(Brix)를 측정하고, 몰농도(mol/L)를 계산하여 삼투압을 구한다.
Sample
증류수 (ml)
설탕 (g)
당도 (Brix)
설탕 몰수 (mol)
몰농도 (mol/L)
1
2
3. 깔대기관의 한 쪽을 손으로 막고 눈금이 보일 정도까지 설탕 용액을 채우고, 반투과성 막을 고무줄로 막는다. (반투과성 막이 찢어지지 않도록 주의한다.)
4. 간이 삼투압계에 깔때기관의 아랫부분이 잠길 만큼 증류수로 채워준다.
5. 시간에 따른 눈금의 상승 정도를 기록하고 예측된 계산 결과와 비교한다.
6. 당도계를 이용하여 반투과성 막 내부의 설탕 혼합물의 당도(Brix)를 측정하여 삼투압에 의한 반응의 완결 여부를 판단한다.
5. 참고문헌
[1] 2018년도 2학년 2학기 실험노트
[2] Basic Physical Chemistry , 207p-209p -삼투압
[3] MSDS-설탕
[4] 위키피디아- 용매와 용질, 삼투



























소개글