목차
1. 요약
2. 서론
3 Theory, Method
4. Result
5. Reference
2. 서론
3 Theory, Method
4. Result
5. Reference
본문내용
법
①완충용액에서는 HA와 A-가 모두 존재
②산성용액에서는 CA- =0, CHA=C0
③염기용액에서는 CHA=0, CA-=C0
이 식을 통해 와 를 구하고, , 이 식을
다음 식에 넣어 를 구한다.
를 구할 수 있다.
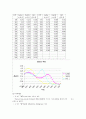
(4) Data처리
HCl의λmax=540에서의 계산
(d=1cm)
,
①산성
②염기성
③Buffer
M
V. 토 의(Discussion)
1) 문헌에 나온 Thymol blue의 pKa값은 9.00으로 우리조의 실험값과 비교해보면 0.03의 오차가 생겼다. 오차율이 아주 적은 잘된 실험이었다.
2) spectrophotometer를 사용하는데 있어서 일정시간의 예열 시간이 필요하고 cell을 다룰 때 손으로 막 만지게 되면 지문과 같은 이물질이 cell표면에서 흡광도를 정확하게 측정하는데 방해할 수 있기 때문에 조심해서 다루어야 하겠다.
3) HCl 즉 산성 조건에서 Thymol blue를 첨가하면 용액의 색깔은 붉은 색을 보였다. 그리고 NaOH에서 노란색을 보이고, 완충용액에서 초록색을 보였다. 즉 Thymol blue는 H+가 많으면 붉은 색을 보이고 OH-가 많으면 노란색을 보임을 알 수 있다. 실험 결과 HCl에서 540nm의 파장 빛을 가장 많이 흡수하고, NaOH에서 440nm파장의 빛을 가장 많이 흡수했다.
4) Thymol blue가 녹아 있는 산과 염기는 다른 electronic 구조 때문에 전자기 복사선의 가시선 영역의 흡수 파장 범위가 다르게 된다.
V. 참고문헌 (Reference)
* 물리화학실험 대한화학회 청문각 * 일반화학 *물리화학실험 한양대출판부
①완충용액에서는 HA와 A-가 모두 존재
②산성용액에서는 CA- =0, CHA=C0
③염기용액에서는 CHA=0, CA-=C0
이 식을 통해 와 를 구하고, , 이 식을
다음 식에 넣어 를 구한다.
를 구할 수 있다.
(4) Data처리
HCl의λmax=540에서의 계산
(d=1cm)
,
①산성
②염기성
③Buffer
M
V. 토 의(Discussion)
1) 문헌에 나온 Thymol blue의 pKa값은 9.00으로 우리조의 실험값과 비교해보면 0.03의 오차가 생겼다. 오차율이 아주 적은 잘된 실험이었다.
2) spectrophotometer를 사용하는데 있어서 일정시간의 예열 시간이 필요하고 cell을 다룰 때 손으로 막 만지게 되면 지문과 같은 이물질이 cell표면에서 흡광도를 정확하게 측정하는데 방해할 수 있기 때문에 조심해서 다루어야 하겠다.
3) HCl 즉 산성 조건에서 Thymol blue를 첨가하면 용액의 색깔은 붉은 색을 보였다. 그리고 NaOH에서 노란색을 보이고, 완충용액에서 초록색을 보였다. 즉 Thymol blue는 H+가 많으면 붉은 색을 보이고 OH-가 많으면 노란색을 보임을 알 수 있다. 실험 결과 HCl에서 540nm의 파장 빛을 가장 많이 흡수하고, NaOH에서 440nm파장의 빛을 가장 많이 흡수했다.
4) Thymol blue가 녹아 있는 산과 염기는 다른 electronic 구조 때문에 전자기 복사선의 가시선 영역의 흡수 파장 범위가 다르게 된다.
V. 참고문헌 (Reference)
* 물리화학실험 대한화학회 청문각 * 일반화학 *물리화학실험 한양대출판부

























소개글