목차
결과
토의
토의
본문내용
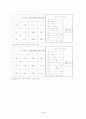
3.047
62.232
61.494
0.01M
25℃
58.997
58.451
57.691
35℃
60.506
59.836
59.046
50℃
62.821
62.153
61.327
위 △G을 아래있는 △G와 △H와의 관계식을 이용하여 △S도 구할수 있다
ex)25℃ ,35℃ ,50℃ 1M 글리세린의 △H 측정
T=298K
T=308K
T=323K
평균기울기=-1.64×=
H=14.5639(25℃)
H=15.5577(35℃)
H=17.1099(50℃)
위와 같은 방법으로 나머지도 구하면...
각시료의 H값
글리세린
CH3COOCH3
CH3COOH
1M
25℃
14.5639
58.9659
59.3211
35℃
15.5577
62.9897
63.3692
50℃
17.1099
69.2745
69.6918
0.1M
25℃
-24.5099
60.0315
60.7419
35℃
-26.1825
64.1281
64.8870
50℃
-28.7948
70.5264
71.3610
0.01M
25℃
12.4326
61.8076
62.1628
35℃
13.2810
66.0253
66.4048
50℃
14.6061
72.6130
73.0303
위의 깁스에너지와 엔탈피를 아래식을 이용해서 엔트로피를 구할수 있다
ex)25℃ 1M 글리세린의 엔트로피 측정
위와 같은 방법으로 계산하면...
각시료의 △S값
글리세린
CH3COOCH3
CH3COOH
1M
25℃
-0.15067
0.00023
0.00374865
35℃
-0.14699
0.0089048
0.012377
50℃
-0.142461
0.020877
0.02437399
0.1M
25℃
-0.27056
0.00487416
0.00946946
35℃
-0.28155
0.0134938
0.01838311
50℃
-0.284339
0.0256792
0.030547987
0.01M
25℃
-0.156256
0.011263758
0.01500604
35℃
-0.153327
0.020095129
0.023892207
50℃
-0.149272
0.0323839
0.036233126
토의
이번 실험은 시료의 분자량, 몰농도, 온도 등에 의해서 액체의 점성도가 어떻게 달라지는 가를 실험함과 동시에 거기에 따른 역학적 에너지 즉 △G, △H ,△S 들도 구해보고자 한 실험이었다.
이 실험은 우리가 물리화학 실험을 하는 처음실험으로 우리조가 이번에 할 실험준비 세미나를 맡았는데 우리가 맡아서 공부한 실험이었음에도 불구하고 실험을 재대로 이행하지 못한대에 대하여 부끄럽게 여긴다.
어찌됐거나 이번 실험에서 우리는 위의 결과값과 그래프에서도 한눈에 알아볼수 있듯이 실험적으로 분자량이 증가할수록 점성도가 증가하고, 온도가 증가함에 따라서 점성도는 감소하고, 또한 몰농도가 증가할수록 점성도가 증가함을 알아낼수 있었다.
하지만 우리는 이 실험에서 점성도의 경향성은 알아낼 수 있었지만 그 값들이 정확하게 그 시료의 점성도인지는 알아내거나 그에따른 오차를 측정하는 실험은 아니였고 위에서 언급했던 경향성만은 알아보는 실험이었다.
또한 이 실험에서 역학적 에너지들을 구해볼 수 있었는데 이 값들의 경향성에 대해서는 같은 시료의 같은 몰농도에서는 온도가 증가할수록 △G에너지는 증가하고 △H도 증가하였다 또한△S도 약간의 증가를 보였지만 그 외에 분자량의 관계라던가 몰농도와의 관계는 이 실험으로 명확하게 알아낼 수가 없었고 이 실험에서 얻은 경향성 또한 이론적으로 정확한지에 대해서도 의문이다
아무튼 미흡한 이번 실험에서 우리가 얻고자한 경향성들이 뚜렷하진 않지만 나타났다는 것에 대해서 만족하고 다음 실험은 더욱 많은 것을 준비해서 이번과 같은 과오를 하지 않도록 해야 하겠다
62.232
61.494
0.01M
25℃
58.997
58.451
57.691
35℃
60.506
59.836
59.046
50℃
62.821
62.153
61.327
위 △G을 아래있는 △G와 △H와의 관계식을 이용하여 △S도 구할수 있다
ex)25℃ ,35℃ ,50℃ 1M 글리세린의 △H 측정
T=298K
T=308K
T=323K
평균기울기=-1.64×=
H=14.5639(25℃)
H=15.5577(35℃)
H=17.1099(50℃)
위와 같은 방법으로 나머지도 구하면...
각시료의 H값
글리세린
CH3COOCH3
CH3COOH
1M
25℃
14.5639
58.9659
59.3211
35℃
15.5577
62.9897
63.3692
50℃
17.1099
69.2745
69.6918
0.1M
25℃
-24.5099
60.0315
60.7419
35℃
-26.1825
64.1281
64.8870
50℃
-28.7948
70.5264
71.3610
0.01M
25℃
12.4326
61.8076
62.1628
35℃
13.2810
66.0253
66.4048
50℃
14.6061
72.6130
73.0303
위의 깁스에너지와 엔탈피를 아래식을 이용해서 엔트로피를 구할수 있다
ex)25℃ 1M 글리세린의 엔트로피 측정
위와 같은 방법으로 계산하면...
각시료의 △S값
글리세린
CH3COOCH3
CH3COOH
1M
25℃
-0.15067
0.00023
0.00374865
35℃
-0.14699
0.0089048
0.012377
50℃
-0.142461
0.020877
0.02437399
0.1M
25℃
-0.27056
0.00487416
0.00946946
35℃
-0.28155
0.0134938
0.01838311
50℃
-0.284339
0.0256792
0.030547987
0.01M
25℃
-0.156256
0.011263758
0.01500604
35℃
-0.153327
0.020095129
0.023892207
50℃
-0.149272
0.0323839
0.036233126
토의
이번 실험은 시료의 분자량, 몰농도, 온도 등에 의해서 액체의 점성도가 어떻게 달라지는 가를 실험함과 동시에 거기에 따른 역학적 에너지 즉 △G, △H ,△S 들도 구해보고자 한 실험이었다.
이 실험은 우리가 물리화학 실험을 하는 처음실험으로 우리조가 이번에 할 실험준비 세미나를 맡았는데 우리가 맡아서 공부한 실험이었음에도 불구하고 실험을 재대로 이행하지 못한대에 대하여 부끄럽게 여긴다.
어찌됐거나 이번 실험에서 우리는 위의 결과값과 그래프에서도 한눈에 알아볼수 있듯이 실험적으로 분자량이 증가할수록 점성도가 증가하고, 온도가 증가함에 따라서 점성도는 감소하고, 또한 몰농도가 증가할수록 점성도가 증가함을 알아낼수 있었다.
하지만 우리는 이 실험에서 점성도의 경향성은 알아낼 수 있었지만 그 값들이 정확하게 그 시료의 점성도인지는 알아내거나 그에따른 오차를 측정하는 실험은 아니였고 위에서 언급했던 경향성만은 알아보는 실험이었다.
또한 이 실험에서 역학적 에너지들을 구해볼 수 있었는데 이 값들의 경향성에 대해서는 같은 시료의 같은 몰농도에서는 온도가 증가할수록 △G에너지는 증가하고 △H도 증가하였다 또한△S도 약간의 증가를 보였지만 그 외에 분자량의 관계라던가 몰농도와의 관계는 이 실험으로 명확하게 알아낼 수가 없었고 이 실험에서 얻은 경향성 또한 이론적으로 정확한지에 대해서도 의문이다
아무튼 미흡한 이번 실험에서 우리가 얻고자한 경향성들이 뚜렷하진 않지만 나타났다는 것에 대해서 만족하고 다음 실험은 더욱 많은 것을 준비해서 이번과 같은 과오를 하지 않도록 해야 하겠다




























소개글