본문내용
간과할 수 없었다. 실험시에 산-염기의 첨가 이전의 용액 자체 pH값을 측정할 때 두 차례정도 수치의 오류가 발생하였다. 이런 점을 미루어 보았을때 - pH값이 나온점은 실험시 측정기의 표준화를 다시 확인하지 않고 넘어간점도 있지만, 기기의 기계적인 오류도 상당부분 이런 결과를 나타나게한 원인으로 해석되었다.
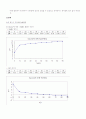
④ buffer 1의 실험에 있어서 Na₂HPO₄: NaH₂PO4의 비율을 1:10, 10:10으로 섞은후 HCl의 첨가시의 pH값을 측정한 결과 값이 완만하게 낮아지는 것을 볼 수 있었다. 산의 첨가에 있어서 짝산의 증가로 인해 값이 낮아진것 같다. 1:10, 10:10의 두 경우 모두 pH값이 낮아지는 결과를 보여주었다. 값이 급격하게 낮아지느 ㄴ점을 보이지 않았다는 점에 있어서 교수님께서 세 번째의 10:1의 경우에서 용액의 비율을 이전 실험에서의 1:10, 10:10dptjdml 10ml:100ml, 55ml:55ml가 아닌 10ml:1ml로 용액의 비율을 바꾼후 그 결과를 살펴보라고 하셨었다. 이로 인한 실험결과 용액자체의 pH측정시 8값이 1ml, 5ml, 10ml첨가 추가시에 5ml첨가시에 완만했던 수치가 10ml 첨가시 수치가 6이나 떨어지면서 급격한 변화를 보였다. 이점에 있어서 급격한 변화의 이유를 앞의 실험들을 통해서 유추해 볼 수 있었다.
글리신에서의 양성자 해리에 있어서 쌍성이온 수의 비율이 급격하게 변화하여 그로 인해 pH값이 변화한 것으로 해석할 수 있었다. 우리조는 다름 실험조에 비해서 ④실험의 경우에는 올바른 데이터 결과를 얻을 수 있었지만, ③글리신의 pH적정에 있어서는 - pH값이 나온것에 대해서느 상당한 실험적 오류를 범했다고 할 수 있지만 앞에서 말한 바와 같이 pH측정기의 기계적 오류의 결함이 더 큰 것으로 생각되었다. 실험시 HCl첨가시 이전의 용액 자체의 pH값이 -(마이너스 범위)에서 시작되지 않고 NaOH첨가시 전의 용액자체의 값과 동일한 pH 4.2를 보였다는 것 때문이었다. 이번 실험에서 실험결과의 오류발생 이후, 시간적 문제를 해결하지 못해 pH측정기의 값을 표준화를 다시 조정, 다른 실험조의 pH측정기를 이용해서 재확인을 하지 않았다느 점에서 실험적 태도에 있어서 부족했던 점이 많았던것 같다.
□참고문헌
- 실험생화학[개정3판], 탐구당, 한국생화학회, 1999
- 일반화학 제4판, 녹문당, John McMurry Robert C. Fay, 2005
④ buffer 1의 실험에 있어서 Na₂HPO₄: NaH₂PO4의 비율을 1:10, 10:10으로 섞은후 HCl의 첨가시의 pH값을 측정한 결과 값이 완만하게 낮아지는 것을 볼 수 있었다. 산의 첨가에 있어서 짝산의 증가로 인해 값이 낮아진것 같다. 1:10, 10:10의 두 경우 모두 pH값이 낮아지는 결과를 보여주었다. 값이 급격하게 낮아지느 ㄴ점을 보이지 않았다는 점에 있어서 교수님께서 세 번째의 10:1의 경우에서 용액의 비율을 이전 실험에서의 1:10, 10:10dptjdml 10ml:100ml, 55ml:55ml가 아닌 10ml:1ml로 용액의 비율을 바꾼후 그 결과를 살펴보라고 하셨었다. 이로 인한 실험결과 용액자체의 pH측정시 8값이 1ml, 5ml, 10ml첨가 추가시에 5ml첨가시에 완만했던 수치가 10ml 첨가시 수치가 6이나 떨어지면서 급격한 변화를 보였다. 이점에 있어서 급격한 변화의 이유를 앞의 실험들을 통해서 유추해 볼 수 있었다.
글리신에서의 양성자 해리에 있어서 쌍성이온 수의 비율이 급격하게 변화하여 그로 인해 pH값이 변화한 것으로 해석할 수 있었다. 우리조는 다름 실험조에 비해서 ④실험의 경우에는 올바른 데이터 결과를 얻을 수 있었지만, ③글리신의 pH적정에 있어서는 - pH값이 나온것에 대해서느 상당한 실험적 오류를 범했다고 할 수 있지만 앞에서 말한 바와 같이 pH측정기의 기계적 오류의 결함이 더 큰 것으로 생각되었다. 실험시 HCl첨가시 이전의 용액 자체의 pH값이 -(마이너스 범위)에서 시작되지 않고 NaOH첨가시 전의 용액자체의 값과 동일한 pH 4.2를 보였다는 것 때문이었다. 이번 실험에서 실험결과의 오류발생 이후, 시간적 문제를 해결하지 못해 pH측정기의 값을 표준화를 다시 조정, 다른 실험조의 pH측정기를 이용해서 재확인을 하지 않았다느 점에서 실험적 태도에 있어서 부족했던 점이 많았던것 같다.
□참고문헌
- 실험생화학[개정3판], 탐구당, 한국생화학회, 1999
- 일반화학 제4판, 녹문당, John McMurry Robert C. Fay, 2005
추천자료
 (교육방법) 질문법에 관한 고찰
(교육방법) 질문법에 관한 고찰 [일반화학실험] 기체상수 결정 실험 예비보고서 및 문제 고찰
[일반화학실험] 기체상수 결정 실험 예비보고서 및 문제 고찰 미생물 시험방법 (먹는물 수질환경기준, 전처리방법)
미생물 시험방법 (먹는물 수질환경기준, 전처리방법) (식품미생물학A)유해 미생물의 생육을 억제하거나 사멸시키는 미생물 생육 조절 방법에 대하여
(식품미생물학A)유해 미생물의 생육을 억제하거나 사멸시키는 미생물 생육 조절 방법에 대하여 [일반물리 실험 보고서]길이의 측정, 힘의 평형+++실험결과, 고찰 有
[일반물리 실험 보고서]길이의 측정, 힘의 평형+++실험결과, 고찰 有 [X선][엑스선][X선회절실험][엑스선회절실험][X선회절][엑스선회절][실험]X선(엑스선)의 성질...
[X선][엑스선][X선회절실험][엑스선회절실험][X선회절][엑스선회절][실험]X선(엑스선)의 성질... [살균][가열살균][미생물의 살균][초음파][우주정거장]살균의 개념, 살균의 원리, 살균의 방...
[살균][가열살균][미생물의 살균][초음파][우주정거장]살균의 개념, 살균의 원리, 살균의 방... 교육과정4공통) 교육과정의 접근방법에 대한 비교 고찰
교육과정4공통) 교육과정의 접근방법에 대한 비교 고찰  [실험보고서] 트랜지스터, 스위칭 실험 - 실험 순서 및 결과와 고찰
[실험보고서] 트랜지스터, 스위칭 실험 - 실험 순서 및 결과와 고찰 생물학 실험 - 일상생활에 산재해 있는 미생물 관찰
생물학 실험 - 일상생활에 산재해 있는 미생물 관찰 [미생물 실험]미생물의 현미경관찰 - gram positive, negative
[미생물 실험]미생물의 현미경관찰 - gram positive, negative 미생물 세포의 관찰 - 그람염색 : 광학현미경의 사용방법을 익히고 미생물 세포를 그람염색을...
미생물 세포의 관찰 - 그람염색 : 광학현미경의 사용방법을 익히고 미생물 세포를 그람염색을... 화공실험 막분리 실험 예비, 결과, 고찰 내용
화공실험 막분리 실험 예비, 결과, 고찰 내용 인간관계론을 태동시킨 계기가 된 호손실험의 내용을 고찰하고 이 4가지 실험이 인간관계론에...
인간관계론을 태동시킨 계기가 된 호손실험의 내용을 고찰하고 이 4가지 실험이 인간관계론에...


























소개글