목차
1. 제목
2. 실험일자
3. 실험목적
4. 이론적 배경
5. 실험 방법
6. 결과 및 DATA 처리
7. 토의 및 고찰
8. 참고문헌
2. 실험일자
3. 실험목적
4. 이론적 배경
5. 실험 방법
6. 결과 및 DATA 처리
7. 토의 및 고찰
8. 참고문헌
본문내용
능하므로 당량점을 2개만 측정할 수 밖에 없었다.
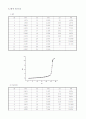
② 위 실험에서의 그래프와 참고문헌의 그래프를 비교하여 보자.
참고 문헌 그래프를 보게 되면 강산 - 강염기 반응의 경우 당량점에서의 pH 변화가 거의 수직에 가까움을 보여준 다. 그리고 농도가 진할수록 pH 변화량은 더욱 커진다.
③ 문헌에 나와 있는 Ka 값은 다음과 같다.
HCl
CH3COOH
H3PO4
K1
1 × 10-7
1.75 × 10-5
1.1 × 10-2
K2
-
-
7.5 × 10-8
K3
-
-
4.8 × 10-13
이번 실험에서 구해야 할 것 중에 하나가 약산과 강염기 적정 시 그 산들의 Ka 값이다.
④ 실험을 할 때에는 시료의 농도 측정을 정확히 해주어야 한다. 특히 산의 농도와 같은 경우 0.1N NaOH와 반응하기 때문에 정확하게 0.1N이 되도록 시료들의 농도를 측정해야 한다.
⑤ pH 미터기를 사용함에 있어서 교반하는 도중에 pH를 측정하면 pH 미터기의 수치가 한 곳에 머무르지 않고 계속 해서 변화하는 것을 볼 수 있었다. 교반과 동시에 pH 측정을 최대한 지양하고 어느 정도 교반이 되면 교반기를 끄 고 측정하는 것이 좋다.
⑥ 급변범위를 사전에 알고 실험을 하는 것이 중요하다.
pH 변화가 급격히 일어나는 구간에서는 NaOH를 극소량 첨가시켜 주어야 정확한 실험 결과를 알 수 있으므로 급 변범위 및 당량점 등을 사전에 파악하는 것이 좋다.
⑦ 약한 산 인 CH3COOH 수용액을 예를 들어서 \'이온화 상수 Ka와 이온화도 α\'를 연관시켜서 생각해 보자. (물의 농 도는 거의 일정하므로, 무시될 수 있다.)
CH3COOH
H+
+
CH3COO-
초기 상태 농도 (mol/L)
C
0
0
이온화 후 농도 (mol/L)
-Cα
Cα
Cα
평형 상태 농도 (mol/L)
(1-α)C
Cα
Cα
\'산의 수소 이온 농도 = 몰농도 x 이온화도\' 이므로, [H3O+] = Cα 이며, Ka 는 다음과 같다.
Ka = [H+][CH3COO- ]/[CH3COOH] = ( Cα x Cα ) / (1-α)C = Cα2 / (1-α)
약한 산에서 1-α ≒ 1 이므로 ,
Ka = Cα2
이온화도α 는 온도가 높을수록, 농도가 묽을수록 커진다고 하였는데, Ka는 온도에 의해서만 변한다.
이 관계는 Ka = Cα2 을 생각하면 된다.
⑧ 실험을 위해 필요한 시료를 만드는 법에 대해 기술하고자 한다. 지금까지는 대부분이 고체(가루)로 이루어진 시료 를 사용하면서 실험을 해왔지만, 이번에는 액체시료를 주로 사용하게 되면서 농도계산이 전보다 훨씬 복잡하게 이 루어졌다. 더군다나 종전까지는 대부분 실험실에 1N 시약을 그대로 사용하였지만, 이번 실험 같은 경우에는 농도 를 실험과정에 맞게 바꿔서 실험을 실시하였다.
이 계산에 대한 방법은 다음과 같다.
㉠ 0.1N HCL 200ml 로 만드는 방법
1N의 HCl은 36.5g HCl 이므로 200ml의 0.1N의 HCl은 0.73g HCl
비중이 1.12g/ml 이므로
0.65HCl + 199.35ml 증류수 => 0.1N HCl 200ml
㉡ 0.1N NaOH 200ml로 만드는 방법
0.8g NaOH + 200ml 증류수 => 0.1N NaOH 200ml
㉢ 0.1N CH3COOH 200ml로 만드는 방법
1N의 CH3COOH는 60.05g CH3COOH 이므로 200ml의 0.1N CH3COOH는 1.201g CH3COOH
비중이 1.05g/ml 이므로
1.15ml CH3COOH + 198.85ml 증류수 => 0.1N CH3COOH 200ml
㉣ 0.05M H3PO4 200ml로 만드는 방법
H3PO 85% 이므로
비중이 거의 1에 가까우므로
2.87ml H3PO4 + 197.13ml 증류수 => 0.05M H3PO4 200ml
⑨ 대부분의 다가약산에서 이다.
의 크기는 104~105 정도인데 그 첫 번째 이유는 정전기력 때문이다. 즉, 첫째 해리에서는 단일음전하에서 단일 양전하인 히드로늄 이온분자가 포함되기 때문이다. 두 번째 단계에서의 히드로늄 이온은 이중음전하로부터 분리 되면서, 많은 에너지를 필요로 하기 때문이다. 두 번째 이유는 통계적인 이유이다. 첫단계에서는 하나의 양성자가 두 곳에서 제거될 수 있는 반면에 두 번째 단계에서는 하나만 제거될 수 있다. 따라서 첫 번째 해리가 두 번째 해리에 비해 두 배의 확률을 가진다.
8. 참 고 문 헌
물리화학실험 (탐구당) p163~165
물리화학실험 (서문출판사) P57 ~ P60
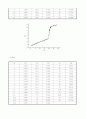
② 위 실험에서의 그래프와 참고문헌의 그래프를 비교하여 보자.
참고 문헌 그래프를 보게 되면 강산 - 강염기 반응의 경우 당량점에서의 pH 변화가 거의 수직에 가까움을 보여준 다. 그리고 농도가 진할수록 pH 변화량은 더욱 커진다.
③ 문헌에 나와 있는 Ka 값은 다음과 같다.
HCl
CH3COOH
H3PO4
K1
1 × 10-7
1.75 × 10-5
1.1 × 10-2
K2
-
-
7.5 × 10-8
K3
-
-
4.8 × 10-13
이번 실험에서 구해야 할 것 중에 하나가 약산과 강염기 적정 시 그 산들의 Ka 값이다.
④ 실험을 할 때에는 시료의 농도 측정을 정확히 해주어야 한다. 특히 산의 농도와 같은 경우 0.1N NaOH와 반응하기 때문에 정확하게 0.1N이 되도록 시료들의 농도를 측정해야 한다.
⑤ pH 미터기를 사용함에 있어서 교반하는 도중에 pH를 측정하면 pH 미터기의 수치가 한 곳에 머무르지 않고 계속 해서 변화하는 것을 볼 수 있었다. 교반과 동시에 pH 측정을 최대한 지양하고 어느 정도 교반이 되면 교반기를 끄 고 측정하는 것이 좋다.
⑥ 급변범위를 사전에 알고 실험을 하는 것이 중요하다.
pH 변화가 급격히 일어나는 구간에서는 NaOH를 극소량 첨가시켜 주어야 정확한 실험 결과를 알 수 있으므로 급 변범위 및 당량점 등을 사전에 파악하는 것이 좋다.
⑦ 약한 산 인 CH3COOH 수용액을 예를 들어서 \'이온화 상수 Ka와 이온화도 α\'를 연관시켜서 생각해 보자. (물의 농 도는 거의 일정하므로, 무시될 수 있다.)
CH3COOH
H+
+
CH3COO-
초기 상태 농도 (mol/L)
C
0
0
이온화 후 농도 (mol/L)
-Cα
Cα
Cα
평형 상태 농도 (mol/L)
(1-α)C
Cα
Cα
\'산의 수소 이온 농도 = 몰농도 x 이온화도\' 이므로, [H3O+] = Cα 이며, Ka 는 다음과 같다.
Ka = [H+][CH3COO- ]/[CH3COOH] = ( Cα x Cα ) / (1-α)C = Cα2 / (1-α)
약한 산에서 1-α ≒ 1 이므로 ,
Ka = Cα2
이온화도α 는 온도가 높을수록, 농도가 묽을수록 커진다고 하였는데, Ka는 온도에 의해서만 변한다.
이 관계는 Ka = Cα2 을 생각하면 된다.
⑧ 실험을 위해 필요한 시료를 만드는 법에 대해 기술하고자 한다. 지금까지는 대부분이 고체(가루)로 이루어진 시료 를 사용하면서 실험을 해왔지만, 이번에는 액체시료를 주로 사용하게 되면서 농도계산이 전보다 훨씬 복잡하게 이 루어졌다. 더군다나 종전까지는 대부분 실험실에 1N 시약을 그대로 사용하였지만, 이번 실험 같은 경우에는 농도 를 실험과정에 맞게 바꿔서 실험을 실시하였다.
이 계산에 대한 방법은 다음과 같다.
㉠ 0.1N HCL 200ml 로 만드는 방법
1N의 HCl은 36.5g HCl 이므로 200ml의 0.1N의 HCl은 0.73g HCl
비중이 1.12g/ml 이므로
0.65HCl + 199.35ml 증류수 => 0.1N HCl 200ml
㉡ 0.1N NaOH 200ml로 만드는 방법
0.8g NaOH + 200ml 증류수 => 0.1N NaOH 200ml
㉢ 0.1N CH3COOH 200ml로 만드는 방법
1N의 CH3COOH는 60.05g CH3COOH 이므로 200ml의 0.1N CH3COOH는 1.201g CH3COOH
비중이 1.05g/ml 이므로
1.15ml CH3COOH + 198.85ml 증류수 => 0.1N CH3COOH 200ml
㉣ 0.05M H3PO4 200ml로 만드는 방법
H3PO 85% 이므로
비중이 거의 1에 가까우므로
2.87ml H3PO4 + 197.13ml 증류수 => 0.05M H3PO4 200ml
⑨ 대부분의 다가약산에서 이다.
의 크기는 104~105 정도인데 그 첫 번째 이유는 정전기력 때문이다. 즉, 첫째 해리에서는 단일음전하에서 단일 양전하인 히드로늄 이온분자가 포함되기 때문이다. 두 번째 단계에서의 히드로늄 이온은 이중음전하로부터 분리 되면서, 많은 에너지를 필요로 하기 때문이다. 두 번째 이유는 통계적인 이유이다. 첫단계에서는 하나의 양성자가 두 곳에서 제거될 수 있는 반면에 두 번째 단계에서는 하나만 제거될 수 있다. 따라서 첫 번째 해리가 두 번째 해리에 비해 두 배의 확률을 가진다.
8. 참 고 문 헌
물리화학실험 (탐구당) p163~165
물리화학실험 (서문출판사) P57 ~ P60





























소개글