본문내용
알 수 있다.
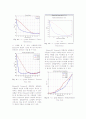
그림 17을 보면, Ethanol과 Tetrahydrofuran의 혼합용액에서 나타나는 그래프는 이론값과 매우 유사한 것을 알 수 있다.
5. 오차분석 및 고찰
5.1 실험기구에 대한 조작법
본 실험에 사용한 실험장치와 실험방법은 오차가 크게 날 수 있는 원시적인 것이다. 따라서 실험기구와 방법에 대한 이해는 결과 분석의 중요한 요소가 된다.
액체의 조성에 따른 Bubble T의 측정은 액체가 기화되서 포화했을 때, 즉, bubble temperature로써 온도가 더디게 올라가는 때에 행해져야 한다. 그러나 본 실험에서는 플라스크가 작고 온도계가 기체의 온도를 측정하도록 설계되어 있기 때문에 수동적으로 가열기를 조작해주지 않으면, bubble temperature보다 훨씬 낮은 잘못된 온도 데이터를 얻게 된다. 그러므로 bubble T일 때의 기상의 온도와 밀도를 정확하게 측정하기 위해서는 둥근 바닥 플라스크에서 bubble T가 될 때까지 기체가 갇히게 가열기를 수동조작한 후 온도가 더디게 변하는 시점에서 가열기를 작동하여 그 때의 기체를 포집해야 한다. 휘발성이 크거나 비열이 작은 용액일 경우, 빠르게 기화되어 bubble T가 아닌 온도에서 액체를 포집할 수 있기 때문이다.
5.2 이론 그래프와 실험 그래프의 비교
기체의 분율을 알기 위해서는 혼합물 용액의 온도를 가열하면서 끓는점에 도달할 때 기체가 액화된 것을 포집하여 Fig6-8을 이용하여 기상의 분율인 y를 결정한다. 그러나 이는 매우 부정확하다. 밀도-액상분율 그래프를 이용하여야 하기 때문에 혼합물질 간의 어느 정도의 밀도차가 있어야 한다. 만약 밀도가 거의 같은 두 물질을 사용한다면 밀도-액상분율 관계식에 기상의 밀도를 넣어 찾은 y 값은 신뢰할 수 없다. 이를 고려하여 밀도차가 어느 정도 나는 물질들을 선택했으나 그 차이가 0.2~0.4 정도로 미세하여 오차의 원인이 된다. 또한 포집된 액체의 밀도를 측정할 때, 그 양이 0.3ml로 극소량이기 때문에 또한 y값의 오차를 예상할 수 있다.
기액평형실험에서 액상 분율 x와 기상 분율 y를 측정할 때, 액상 바로 위에 존재하는 기상의 조성을 측정하는 것이 중요하다. 그러나 본 실험에서 기상의 조성을 알아보기 위하여 포집한 액체는 기상과 그 위치가 많이 떨어져 있다. 가열하는 둥근 바닥 플라스크에서 K자형 아답터를 통해서 가는 동안 온도변화가 3~5℃정도 차이가 나는 것을 통해서도 이를 유추해 볼 수 있다.
즉, 두 용액간의 미세한 밀도차와 기상조성의 측정에 관한 것은 이론 그래프와 실험 data의 오차를 설명해준다.
Data base를 통해 azeotrope를 조사해보면, Ethanol+Water과 Ethanol+Toluene은 공비점이 존재하지만, Ethanol+Tetra-
hydrofuran은 존재하지 않는다. 그러나 실험에서 얻은 T-x-y 그래프를 보면 겹쳐지는 구간이 있어 기울기의 근소한 차이 때문에 겹쳐보이는 것인지, 공비점인지에 대한 판단이 어렵다. 그러나 이론적으로 공비점이 없으므로 기울기의 근소한 차이에 의해 겹쳐보이는 것이 맞다.
6. 결 론
일반적으로 실험을 행할 때, 실험기구에 대한 올바른 조작법과 이해는 중요하다. 본 실험에서는 결과값이 미량이었으며, 순간적으로 측정되었다. 따라서 이는 단순히 실험기구와 조작법에 대한 이해로 끝나지 않는다. 왜냐하면 시약의 물성에 대한 이해가 선행되어야 올바른 조작을 하여 신뢰할만한 데이터를 얻을 수 있기 때문이다. 어쩌면 시약에 대한 이해는 본 논문에서 도출한 그래프보다도 더 근본적인 기액평형의 자료라고 할 수 있다.
두 물질을 섞은 혼합물의 T-x-y 그래프는 그 경향성에 있어서 이론 그래프와 비슷했다. 그러나 미량의 결과값과 밀도를 통한 데이터분석방법에 의해 오차가 발생했음을 유추할 수 있다. 밀도가 아닌 더 고차원적인 기액평형 데이터의 분석법이 필요하다.
참고문헌
1. J. M. Smith · H. C. Van Ness · M. M. Abbott, 『화학공학 열역학』, 7th Edition; Mc Graw Hill, 2007년, pp195-196
2. Robert H. Perry · Don Green, Perry\'s, Chemical Engineers\' Handbook, 6th Ed; 1987
3. Mc. Murry · John, Organic Chemistry, Thomson, 7th Edition; 2008
4. http://www.cheric.org
그림 17을 보면, Ethanol과 Tetrahydrofuran의 혼합용액에서 나타나는 그래프는 이론값과 매우 유사한 것을 알 수 있다.
5. 오차분석 및 고찰
5.1 실험기구에 대한 조작법
본 실험에 사용한 실험장치와 실험방법은 오차가 크게 날 수 있는 원시적인 것이다. 따라서 실험기구와 방법에 대한 이해는 결과 분석의 중요한 요소가 된다.
액체의 조성에 따른 Bubble T의 측정은 액체가 기화되서 포화했을 때, 즉, bubble temperature로써 온도가 더디게 올라가는 때에 행해져야 한다. 그러나 본 실험에서는 플라스크가 작고 온도계가 기체의 온도를 측정하도록 설계되어 있기 때문에 수동적으로 가열기를 조작해주지 않으면, bubble temperature보다 훨씬 낮은 잘못된 온도 데이터를 얻게 된다. 그러므로 bubble T일 때의 기상의 온도와 밀도를 정확하게 측정하기 위해서는 둥근 바닥 플라스크에서 bubble T가 될 때까지 기체가 갇히게 가열기를 수동조작한 후 온도가 더디게 변하는 시점에서 가열기를 작동하여 그 때의 기체를 포집해야 한다. 휘발성이 크거나 비열이 작은 용액일 경우, 빠르게 기화되어 bubble T가 아닌 온도에서 액체를 포집할 수 있기 때문이다.
5.2 이론 그래프와 실험 그래프의 비교
기체의 분율을 알기 위해서는 혼합물 용액의 온도를 가열하면서 끓는점에 도달할 때 기체가 액화된 것을 포집하여 Fig6-8을 이용하여 기상의 분율인 y를 결정한다. 그러나 이는 매우 부정확하다. 밀도-액상분율 그래프를 이용하여야 하기 때문에 혼합물질 간의 어느 정도의 밀도차가 있어야 한다. 만약 밀도가 거의 같은 두 물질을 사용한다면 밀도-액상분율 관계식에 기상의 밀도를 넣어 찾은 y 값은 신뢰할 수 없다. 이를 고려하여 밀도차가 어느 정도 나는 물질들을 선택했으나 그 차이가 0.2~0.4 정도로 미세하여 오차의 원인이 된다. 또한 포집된 액체의 밀도를 측정할 때, 그 양이 0.3ml로 극소량이기 때문에 또한 y값의 오차를 예상할 수 있다.
기액평형실험에서 액상 분율 x와 기상 분율 y를 측정할 때, 액상 바로 위에 존재하는 기상의 조성을 측정하는 것이 중요하다. 그러나 본 실험에서 기상의 조성을 알아보기 위하여 포집한 액체는 기상과 그 위치가 많이 떨어져 있다. 가열하는 둥근 바닥 플라스크에서 K자형 아답터를 통해서 가는 동안 온도변화가 3~5℃정도 차이가 나는 것을 통해서도 이를 유추해 볼 수 있다.
즉, 두 용액간의 미세한 밀도차와 기상조성의 측정에 관한 것은 이론 그래프와 실험 data의 오차를 설명해준다.
Data base를 통해 azeotrope를 조사해보면, Ethanol+Water과 Ethanol+Toluene은 공비점이 존재하지만, Ethanol+Tetra-
hydrofuran은 존재하지 않는다. 그러나 실험에서 얻은 T-x-y 그래프를 보면 겹쳐지는 구간이 있어 기울기의 근소한 차이 때문에 겹쳐보이는 것인지, 공비점인지에 대한 판단이 어렵다. 그러나 이론적으로 공비점이 없으므로 기울기의 근소한 차이에 의해 겹쳐보이는 것이 맞다.
6. 결 론
일반적으로 실험을 행할 때, 실험기구에 대한 올바른 조작법과 이해는 중요하다. 본 실험에서는 결과값이 미량이었으며, 순간적으로 측정되었다. 따라서 이는 단순히 실험기구와 조작법에 대한 이해로 끝나지 않는다. 왜냐하면 시약의 물성에 대한 이해가 선행되어야 올바른 조작을 하여 신뢰할만한 데이터를 얻을 수 있기 때문이다. 어쩌면 시약에 대한 이해는 본 논문에서 도출한 그래프보다도 더 근본적인 기액평형의 자료라고 할 수 있다.
두 물질을 섞은 혼합물의 T-x-y 그래프는 그 경향성에 있어서 이론 그래프와 비슷했다. 그러나 미량의 결과값과 밀도를 통한 데이터분석방법에 의해 오차가 발생했음을 유추할 수 있다. 밀도가 아닌 더 고차원적인 기액평형 데이터의 분석법이 필요하다.
참고문헌
1. J. M. Smith · H. C. Van Ness · M. M. Abbott, 『화학공학 열역학』, 7th Edition; Mc Graw Hill, 2007년, pp195-196
2. Robert H. Perry · Don Green, Perry\'s, Chemical Engineers\' Handbook, 6th Ed; 1987
3. Mc. Murry · John, Organic Chemistry, Thomson, 7th Edition; 2008
4. http://www.cheric.org





























소개글