목차
6장 혼합물의 성질
6.1 농도의 측정
6.2 부분 몰 성질(partial molar property)
6.3 자발적 혼합
6.4 이상용액(ideal solution)
6.5 이상희석용액
6.6 실제 용액 : 활동도
6.7 끓는점과 어는점의 변화
6.8 삼투(Osmosis)
6.9 휘발성 액체의 혼합물
6.10 액체-액체 상도표
6.11 액체-고체 상도표
6.1 농도의 측정
6.2 부분 몰 성질(partial molar property)
6.3 자발적 혼합
6.4 이상용액(ideal solution)
6.5 이상희석용액
6.6 실제 용액 : 활동도
6.7 끓는점과 어는점의 변화
6.8 삼투(Osmosis)
6.9 휘발성 액체의 혼합물
6.10 액체-액체 상도표
6.11 액체-고체 상도표
본문내용
52.1 kPa이고 아세톤의 분압이 22.4 kPa이라면 규약 2에의한 각각의 활동도계수를 구하고, 혼합시 Gibbs에너지변화량을 계산하라.
풀이)
or or 참조 표6.2
※ 총괄성질
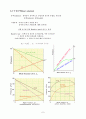
총괄성질(총괄적 성질, colligative property)은 용질의 종류보다 그 분자수, 즉 몰수에 의존하는 묽은 용액의 성질(비휘발성 용질)로서 비점상승, 빙점강하, 삼투압 현상 등이 관련된다.
6.7 끓는점과 어는점의 변화
(6.22)
: 비점상승 , : 비점상승상수
: 빙점강하 , : 빙정강하상수
: 용질의 몰농도
가정: 1. 용질은 비휘발성이므로 기상에는 나타나지 않는다.
2. 용질은 고체 용매에 녹지 않으므로 고체상에는
나타나지 않는다.
빙점강하(depression of freezing point),
비휘발성 고체의 理想 용해도(ideal solubility of solid)
순수 Solid phase = liquid phase
(1성분 : 용매 ) 평형 (ideal solution)
: 순수 1성분 solid → liq. 전이시 잠열 ( enthalphy of fusion ) > 0
* ,
if = 일정. 적분 ⇒
-----------------
오직 1 성분에 대한 값 뿐임
→ 몰분율로 표현되는 solubility는 이상용액을 형성하는 모든 용매에 대해 같다.
> 0이므로 T1f - T > 0 임. 따라서 빙점강하(freezing point depression)
: 온도 T하의 이상용액내 순수 고체 1의 용해도
or
: 순수고체1이 몰분율 x1인 액체(이상용액)과 평형을 이루는 온도
묽은 용액 x1 → 1, x2 ≪ 1 , small,
∴ or
용질 몰분율
: kg/mol of solvent
: molal conc. of solute (mol of solute/kg of solvent) =
: 용질의 분자량 계산
: 어는점 내림 상수
freezing point constant, cryoscopic constant
예) 물에 대한 freezing point canstant?
= 1.86 K (㏖ kg-1)-1
비점상승(elevation of boiling point),
순수 gas phase = liquid phase
( 1 성분 : 용매 ) 평형 ( ideal solution )
( gas, T, P ) = =
순수 1성분 gas → liq 전이시 잠열 (enthalphy of condensation)
, 일정
∵ 이므로
: 비점상승(boiling point elevation)
( )
∴
: 끓는점 오름 상수, ebullioscopic constant
6.8 삼투(Osmosis)
삼투압 : osmotic pressure
반투막 : 용매는 투과하나 용질은 투과하지 못하는 막
(semipermeable membrane)
화학포텐셜(Ch. P.) : 높은 곳 → 낮은 곳, 물질이동
o
┖→ 성분 i 가 순수할 때 Ch. P
즉, 용액중 용매의 Ch. P은 가해진 용질에 의해 감소
따라서 용매 → 용액 방향으로 확산됨.
이 현상을 삼투(osmosis),
이때 생기는 막 사이 압력을 삼투압(osmotic pressure),
o 압력변화시 Ch. P 의 변화
이므로
용액중 용매의 Ch. P 은 가해준 압력에 의해 증가
* 가한 압력 = 삼투압일 때 균형을 이룸
π : osmotic pressure
평형상태 : 순수 용매의 ch.P = 압축된 용액중 용매의 ch.P
를 적용
+
비압축성 유체(액체)에서 일정온도면 : 이므로
,
이므로
용매의 몰 분율: , 는 용질의 몰분율
묽은 용액(희석용액) ( ) 이라면
Van\'t Hoff eq
(6.23a)
(6.23b)
거대 분자(단백질, 합성 고분자)같은 비 이상적인 삼투압
(6.24a)
(6.24b)
혼합물의 상도표
2성분에서
압력을 일정
6.9 휘발성 액체의 혼합물
※ 2성분계 (휘발성 용매 - 휘발성 용질)
단일상,
혹은
두 상, 기-액평형
혹은 혹은
온도, 압력이 규정되면 상도표에서 액체상과 기체상의 조성은 알 수 있으나, 두 상사이의 상대적인 양은 알 수 없다.
o 이슬점(dew point, line, surface) : 단일상인 기체 상으로부터 압력이 올라감에 따라 응축되기 시작하는 점.
o 끓는점(bubble point, line, surface) : 단일상인 액체 상으로부터 압력이 내려감에 따라 증기가 생성되기 시작하는 점.
o 맺음선(tie line)
o 온도-조성 도표 : boiling point diagram
: bubble point line
: dew point line
문제) 60℃, 순수 벤젠 증기압 : , 순수 톨루엔 증기압 :
일 때 벤젠, 톨루엔 분압? 총 증기압? 증기상에서의 톨루엔 몰분율?
풀이) Raoult의 법칙에 의해
문제) 300 K, 순수 벤젠, 톨루엔의 증기압 :
300 K, 벤젠 1몰, 톨루엔 1몰로 구성된 액체혼합물인 a점에서
가) 압력을 감소시킬 때 증기가 처음 발생되는 압력(b점, bubble point)은?
이때 발생되는 증기의 조성은?
나) 압력을 더욱 감소시켜갈 때 액체가 완전히 없어지게 되는 압력(c점, dew point)은?
이때 마지막으로 없어지는 액체의 조성은?
다) 300 K, 일 때 평형에 있는 액체상과 기체상의 조성 및 각 상의 몰수를 구하라.
풀이)
가) 각각 1몰씩 혼합된 액체이므로
총 압력
∴
나) 전부 증발되었다면,
⇒
다)
,
⇒
∴ ,
※ 온도-조성 도표
공비혼합물
Raoult\'s law : 음의 편차 양의 편차
클로로포름/아세톤 에탄올/물
질산/물 디옥산/물
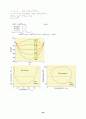
6.10 액체-액체 상도표
부분혼화 액체
: upper critical solution temperature(그림 6.27)
: lower critical solution temperature
(6.25)
,
에 를 곱하면 ,
(6.26a)
발열혼합 :
흡열혼합 :
이상용액 :
(6.26b)
6.11 액체-고체 상도표
공융조성: e를 지난는 수직선
공융점(共晶점, eutectic point) :
, 압력일정,
풀이)
or or 참조 표6.2
※ 총괄성질
총괄성질(총괄적 성질, colligative property)은 용질의 종류보다 그 분자수, 즉 몰수에 의존하는 묽은 용액의 성질(비휘발성 용질)로서 비점상승, 빙점강하, 삼투압 현상 등이 관련된다.
6.7 끓는점과 어는점의 변화
(6.22)
: 비점상승 , : 비점상승상수
: 빙점강하 , : 빙정강하상수
: 용질의 몰농도
가정: 1. 용질은 비휘발성이므로 기상에는 나타나지 않는다.
2. 용질은 고체 용매에 녹지 않으므로 고체상에는
나타나지 않는다.
빙점강하(depression of freezing point),
비휘발성 고체의 理想 용해도(ideal solubility of solid)
순수 Solid phase = liquid phase
(1성분 : 용매 ) 평형 (ideal solution)
: 순수 1성분 solid → liq. 전이시 잠열 ( enthalphy of fusion ) > 0
* ,
if = 일정. 적분 ⇒
-----------------
오직 1 성분에 대한 값 뿐임
→ 몰분율로 표현되는 solubility는 이상용액을 형성하는 모든 용매에 대해 같다.
> 0이므로 T1f - T > 0 임. 따라서 빙점강하(freezing point depression)
: 온도 T하의 이상용액내 순수 고체 1의 용해도
or
: 순수고체1이 몰분율 x1인 액체(이상용액)과 평형을 이루는 온도
묽은 용액 x1 → 1, x2 ≪ 1 , small,
∴ or
용질 몰분율
: kg/mol of solvent
: molal conc. of solute (mol of solute/kg of solvent) =
: 용질의 분자량 계산
: 어는점 내림 상수
freezing point constant, cryoscopic constant
예) 물에 대한 freezing point canstant?
= 1.86 K (㏖ kg-1)-1
비점상승(elevation of boiling point),
순수 gas phase = liquid phase
( 1 성분 : 용매 ) 평형 ( ideal solution )
( gas, T, P ) = =
순수 1성분 gas → liq 전이시 잠열 (enthalphy of condensation)
, 일정
∵ 이므로
: 비점상승(boiling point elevation)
( )
∴
: 끓는점 오름 상수, ebullioscopic constant
6.8 삼투(Osmosis)
삼투압 : osmotic pressure
반투막 : 용매는 투과하나 용질은 투과하지 못하는 막
(semipermeable membrane)
화학포텐셜(Ch. P.) : 높은 곳 → 낮은 곳, 물질이동
o
┖→ 성분 i 가 순수할 때 Ch. P
즉, 용액중 용매의 Ch. P은 가해진 용질에 의해 감소
따라서 용매 → 용액 방향으로 확산됨.
이 현상을 삼투(osmosis),
이때 생기는 막 사이 압력을 삼투압(osmotic pressure),
o 압력변화시 Ch. P 의 변화
이므로
용액중 용매의 Ch. P 은 가해준 압력에 의해 증가
* 가한 압력 = 삼투압일 때 균형을 이룸
π : osmotic pressure
평형상태 : 순수 용매의 ch.P = 압축된 용액중 용매의 ch.P
를 적용
+
비압축성 유체(액체)에서 일정온도면 : 이므로
,
이므로
용매의 몰 분율: , 는 용질의 몰분율
묽은 용액(희석용액) ( ) 이라면
Van\'t Hoff eq
(6.23a)
(6.23b)
거대 분자(단백질, 합성 고분자)같은 비 이상적인 삼투압
(6.24a)
(6.24b)
혼합물의 상도표
2성분에서
압력을 일정
6.9 휘발성 액체의 혼합물
※ 2성분계 (휘발성 용매 - 휘발성 용질)
단일상,
혹은
두 상, 기-액평형
혹은 혹은
온도, 압력이 규정되면 상도표에서 액체상과 기체상의 조성은 알 수 있으나, 두 상사이의 상대적인 양은 알 수 없다.
o 이슬점(dew point, line, surface) : 단일상인 기체 상으로부터 압력이 올라감에 따라 응축되기 시작하는 점.
o 끓는점(bubble point, line, surface) : 단일상인 액체 상으로부터 압력이 내려감에 따라 증기가 생성되기 시작하는 점.
o 맺음선(tie line)
o 온도-조성 도표 : boiling point diagram
: bubble point line
: dew point line
문제) 60℃, 순수 벤젠 증기압 : , 순수 톨루엔 증기압 :
일 때 벤젠, 톨루엔 분압? 총 증기압? 증기상에서의 톨루엔 몰분율?
풀이) Raoult의 법칙에 의해
문제) 300 K, 순수 벤젠, 톨루엔의 증기압 :
300 K, 벤젠 1몰, 톨루엔 1몰로 구성된 액체혼합물인 a점에서
가) 압력을 감소시킬 때 증기가 처음 발생되는 압력(b점, bubble point)은?
이때 발생되는 증기의 조성은?
나) 압력을 더욱 감소시켜갈 때 액체가 완전히 없어지게 되는 압력(c점, dew point)은?
이때 마지막으로 없어지는 액체의 조성은?
다) 300 K, 일 때 평형에 있는 액체상과 기체상의 조성 및 각 상의 몰수를 구하라.
풀이)
가) 각각 1몰씩 혼합된 액체이므로
총 압력
∴
나) 전부 증발되었다면,
⇒
다)
,
⇒
∴ ,
※ 온도-조성 도표
공비혼합물
Raoult\'s law : 음의 편차 양의 편차
클로로포름/아세톤 에탄올/물
질산/물 디옥산/물
6.10 액체-액체 상도표
부분혼화 액체
: upper critical solution temperature(그림 6.27)
: lower critical solution temperature
(6.25)
,
에 를 곱하면 ,
(6.26a)
발열혼합 :
흡열혼합 :
이상용액 :
(6.26b)
6.11 액체-고체 상도표
공융조성: e를 지난는 수직선
공융점(共晶점, eutectic point) :
, 압력일정,









































소개글