목차
1. 목적
2. 이론
3. 실험방법
4. 결과
5. 토의
6. 결론
7. 참고문헌
2. 이론
3. 실험방법
4. 결과
5. 토의
6. 결론
7. 참고문헌
본문내용
유기용매인 B와 우선적으로 섞은 후 농도에 따른 증류수를 넣어 만들었다. 여기서 우리는 미지시료 B와 아세톤과의 상호작용이 잘 이루어 지지 않았다고 생각 할 수 있다. 아세톤의 경우 carbonyl group 에 의한 약간의 UV 흡광이 나타날 수가 있다. 이런 경우 용매의 바탕 값이 거의 없는 것을 사용하는 것이 가장 좋다. 더불어 carbonyl group 이란게 상당한 electrophile 이기 때문에 샘플분자에 비공유전자쌍이 있을 경우 반응해버릴 가능성도 무시는 못한다. 그렇기 때문이 이와 같은 경우 아세톤보다는 chloroform, MC 를 사용하는게 더 좋다고 본다. chloroform 이나 MC 의 경우는 더블본드가 없기 때문에 그다지 UV 흡광이 크게 나타나지 않기 때문이다.
두 번째로는 시료 자체적 특성에 의한 것으로 생각될 수도 있다. 시료 자체가 UV 흡광을 가지지 않는데 여기에 리간드(리간드란; 착물 속에서 중심원자에 결합되어 있는 이온 또는 분자의 총칭이다.)를 붙여서 측정을 하게 되면 리간드는 원래 강한 UV 흡광을 나타내는데 미지시료와 반응해버리면 흡광이 사라지는 경우에는 흡광도가 점점 감소하는 경우도 있다. 즉 리간드가 1 이라는 흡광을 가지면 미지시료의 농도가 증가할수록 시료-ligand complex 를 이룰수록 리간드의 흡광은 감소하게 되는 것이다.
세 번째로 생각할 수 있는 것이 발색단의 컨쥬게이션에 의한 영향이다. 발색단이란 염료나 색소의 발색의 원인이 되는 유기화합물에 포함된 원자단으로 불포화 결합을 함유하고 있어 π전자가 에너지를 흡수하여 들뜨면서 색이 나타나게 된다. 이를테면, 니트로기 ·아조기 ·카르보닐기 ·니트로소기나 탄소-탄소 이중결합 및 삼중결합 ·C=N기 ·티오카르보닐기 ·아족시기 등이 있으며, 발색단의 기가 복수일 경우에 발색하는 힘이 강하게 나타난다.
분자궤도 함수이론에 따르면 p 전자는 컨쥬게이션(conjugation)과정에 의하여 비편재화(delocalization)된다. 비편재화 효과는 p* 궤도함수의 에너지 준위를 보다 낮게 만듬, 반결합적 성질을 작게 만듬. 이 결과로 흡수 극대 파장은 보다 긴 파장 쪽으로 이동한다. 흡수 극대 파장이 긴 파장 쪽으로 이동되면 우리는 흡광도가 낮아지는 현상을 관찰할 수가 있다.
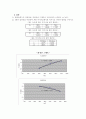
우리는 Beer 법칙을 이용하여 농도에 따른 흡광도는 엑셀을 이용하여 쉽게 , 의 두식을 구할 수가 있었다. 이렇게 구한 식을 토대로 미지시료 C와 D속에 있는 A와 B의 함량을 구해보면 결과에서 나타냈듯이 미지시료 C의 경우 A는 55.03% B는 41.83% 미지시료 D의 경우 A는 66.02% , B는 35.00%인 것을 알 수 있다.
이때 우리가 생각해야하는 것은 미지시료 C와 D는 시료 A와 B의 혼합물이다. 그 말은 C의 경우 A가 55.03%일때 B는 44.97%와 같은 함량을 가져야 된다고 봐야 한다. 이것은 D도 해당되는 말이다. A가 66.02%일때 B는 33.98%의 함량을 가져야 한다. 오차가 발생된 것이다.
우리는 컴퓨터를 이용하여 UV광원을 줄때 거기에 따르는 스펙트럼의 크기를 측정할 수 있었다. 이때 우리는 대조 용액으로 증류수를 사용하였다. 대조용액(바탕용액)은 시료용액 중에서 착색성분만을 제외하고는 다른 모든 조건들은 시료용액과 동일하여야 한다. 용매가 증류수이거나 시약이 무색일 때는 이외의 증류수를 대조용액으로 사용할 수 있다. 그러나 착색성분 이외의 다른 착색성분이 시료용액에 들어 있는 경우에는 대조용액에도 이를 첨가하여야 한다.
실험에서 우리는 대조 용액으로 증류수를 사용했다. 증류수의 피크를 일단 측정한 다음 시료들의 피그를 측정함으로서 우리는 그 시료들의 피크를 알 수 있는 것이다. 하지만 여기에서 오차의 원인을 생각 할 수 있다. 증류수와 시료들을 시료용기에 담는 과정에 시료 겉 표면에 지문이나 물기가 존재할 경우 빛살이 통과하는 과정에 방해 요소로 작용된다. 물론 우리는 시료를 담는 과정에 시료용기의 겉 표면을 휴지로 잘 닦아 주었다. 하지만 휴지로 닦는다고 하여 시료용기 겉 표면의 이물질들이 제대로 제거 되었는지도 의문스럽다. 게다가 농도를 바꿀 때에 시료용기를 단지 아세톤으로 세척만 하고 시료용기를 완전히 말리지 못한 상태에서 다시 실험을 진행하였기에 시료 용기 속에 시료가 완전히 제거되었지 않다고 본다. 이러한 오차들로 인해 우리는 미지시료의 이론적인 함량과는 다른 값을 구한 것으로 보인다.
6. 결론
우리는 이번 실험을 통해 UV분광법이 정량분석에 용이하고, 정성분석에는 다소 제한적이다는 사실을 알았으며, 정량분석을 할때는 검정선이 필요한데, 이때 Beer 법칙을 이용하여 농도에 따른 스펙트럼의 크기를 측정할 필요가 있다는 것을 알 수 있었다. 농도와 흡광도는 비례관계인데, 우리는 농도가 증가함에 따라 흡광도가 감소되는 현상을 관찰할 수 있었고, 그에 따른 원인도 알아보았다.
우리는 실험에 의거하여 검정곡선을 그려 미지시료 C와 D속의 A와B의 함량을 구한 결과 C는 -3.11%의 오차가 있었고, D는 +1.02%의 오차가 있었다.
7. 참고문헌
1)인터넷 참조
http://kin.naver.com/detail/detail.php?d1id=11&dir_id=110204&eid=efvL7SQVakHcOPnpl9sSLkyyV/I2gczq&qb=QmVlcrn9xKI=&pid=ff9kAloi5U4sscZpYLKsss--397822&sid=SS9HBMMmL0kAAEMTH2A
http://blog.daum.net/xingfusesang/8328461
http://100.naver.com/100.nhn?docid=18964
http://100.naver.com/100.nhn?docid=71028
http://100.naver.com/100.nhn?docid=56959
2) 문헌 참조
권수한 외 6인 저 기기분석의 원리 제 5판 355~401
대학 기기 분석 . 기기 분석 교재 연구회 235~298
D.T. Sawter외 2인 저, 박기채외 3인 역, 기기를 이용하는 화학 실험법 183~233
정량 분석 화학(Ⅱ) 91~107
정밀기기분석_수업자료
두 번째로는 시료 자체적 특성에 의한 것으로 생각될 수도 있다. 시료 자체가 UV 흡광을 가지지 않는데 여기에 리간드(리간드란; 착물 속에서 중심원자에 결합되어 있는 이온 또는 분자의 총칭이다.)를 붙여서 측정을 하게 되면 리간드는 원래 강한 UV 흡광을 나타내는데 미지시료와 반응해버리면 흡광이 사라지는 경우에는 흡광도가 점점 감소하는 경우도 있다. 즉 리간드가 1 이라는 흡광을 가지면 미지시료의 농도가 증가할수록 시료-ligand complex 를 이룰수록 리간드의 흡광은 감소하게 되는 것이다.
세 번째로 생각할 수 있는 것이 발색단의 컨쥬게이션에 의한 영향이다. 발색단이란 염료나 색소의 발색의 원인이 되는 유기화합물에 포함된 원자단으로 불포화 결합을 함유하고 있어 π전자가 에너지를 흡수하여 들뜨면서 색이 나타나게 된다. 이를테면, 니트로기 ·아조기 ·카르보닐기 ·니트로소기나 탄소-탄소 이중결합 및 삼중결합 ·C=N기 ·티오카르보닐기 ·아족시기 등이 있으며, 발색단의 기가 복수일 경우에 발색하는 힘이 강하게 나타난다.
분자궤도 함수이론에 따르면 p 전자는 컨쥬게이션(conjugation)과정에 의하여 비편재화(delocalization)된다. 비편재화 효과는 p* 궤도함수의 에너지 준위를 보다 낮게 만듬, 반결합적 성질을 작게 만듬. 이 결과로 흡수 극대 파장은 보다 긴 파장 쪽으로 이동한다. 흡수 극대 파장이 긴 파장 쪽으로 이동되면 우리는 흡광도가 낮아지는 현상을 관찰할 수가 있다.
우리는 Beer 법칙을 이용하여 농도에 따른 흡광도는 엑셀을 이용하여 쉽게 , 의 두식을 구할 수가 있었다. 이렇게 구한 식을 토대로 미지시료 C와 D속에 있는 A와 B의 함량을 구해보면 결과에서 나타냈듯이 미지시료 C의 경우 A는 55.03% B는 41.83% 미지시료 D의 경우 A는 66.02% , B는 35.00%인 것을 알 수 있다.
이때 우리가 생각해야하는 것은 미지시료 C와 D는 시료 A와 B의 혼합물이다. 그 말은 C의 경우 A가 55.03%일때 B는 44.97%와 같은 함량을 가져야 된다고 봐야 한다. 이것은 D도 해당되는 말이다. A가 66.02%일때 B는 33.98%의 함량을 가져야 한다. 오차가 발생된 것이다.
우리는 컴퓨터를 이용하여 UV광원을 줄때 거기에 따르는 스펙트럼의 크기를 측정할 수 있었다. 이때 우리는 대조 용액으로 증류수를 사용하였다. 대조용액(바탕용액)은 시료용액 중에서 착색성분만을 제외하고는 다른 모든 조건들은 시료용액과 동일하여야 한다. 용매가 증류수이거나 시약이 무색일 때는 이외의 증류수를 대조용액으로 사용할 수 있다. 그러나 착색성분 이외의 다른 착색성분이 시료용액에 들어 있는 경우에는 대조용액에도 이를 첨가하여야 한다.
실험에서 우리는 대조 용액으로 증류수를 사용했다. 증류수의 피크를 일단 측정한 다음 시료들의 피그를 측정함으로서 우리는 그 시료들의 피크를 알 수 있는 것이다. 하지만 여기에서 오차의 원인을 생각 할 수 있다. 증류수와 시료들을 시료용기에 담는 과정에 시료 겉 표면에 지문이나 물기가 존재할 경우 빛살이 통과하는 과정에 방해 요소로 작용된다. 물론 우리는 시료를 담는 과정에 시료용기의 겉 표면을 휴지로 잘 닦아 주었다. 하지만 휴지로 닦는다고 하여 시료용기 겉 표면의 이물질들이 제대로 제거 되었는지도 의문스럽다. 게다가 농도를 바꿀 때에 시료용기를 단지 아세톤으로 세척만 하고 시료용기를 완전히 말리지 못한 상태에서 다시 실험을 진행하였기에 시료 용기 속에 시료가 완전히 제거되었지 않다고 본다. 이러한 오차들로 인해 우리는 미지시료의 이론적인 함량과는 다른 값을 구한 것으로 보인다.
6. 결론
우리는 이번 실험을 통해 UV분광법이 정량분석에 용이하고, 정성분석에는 다소 제한적이다는 사실을 알았으며, 정량분석을 할때는 검정선이 필요한데, 이때 Beer 법칙을 이용하여 농도에 따른 스펙트럼의 크기를 측정할 필요가 있다는 것을 알 수 있었다. 농도와 흡광도는 비례관계인데, 우리는 농도가 증가함에 따라 흡광도가 감소되는 현상을 관찰할 수 있었고, 그에 따른 원인도 알아보았다.
우리는 실험에 의거하여 검정곡선을 그려 미지시료 C와 D속의 A와B의 함량을 구한 결과 C는 -3.11%의 오차가 있었고, D는 +1.02%의 오차가 있었다.
7. 참고문헌
1)인터넷 참조
http://kin.naver.com/detail/detail.php?d1id=11&dir_id=110204&eid=efvL7SQVakHcOPnpl9sSLkyyV/I2gczq&qb=QmVlcrn9xKI=&pid=ff9kAloi5U4sscZpYLKsss--397822&sid=SS9HBMMmL0kAAEMTH2A
http://blog.daum.net/xingfusesang/8328461
http://100.naver.com/100.nhn?docid=18964
http://100.naver.com/100.nhn?docid=71028
http://100.naver.com/100.nhn?docid=56959
2) 문헌 참조
권수한 외 6인 저 기기분석의 원리 제 5판 355~401
대학 기기 분석 . 기기 분석 교재 연구회 235~298
D.T. Sawter외 2인 저, 박기채외 3인 역, 기기를 이용하는 화학 실험법 183~233
정량 분석 화학(Ⅱ) 91~107
정밀기기분석_수업자료
키워드
추천자료
 대기오염물 측정
대기오염물 측정 단백질 정량실험 spectrophotometer의 원리와 그를 이용한 시료농도 측정 실험
단백질 정량실험 spectrophotometer의 원리와 그를 이용한 시료농도 측정 실험 HPLC를 이용한 Urine 및 음료속의 카페인 분석
HPLC를 이용한 Urine 및 음료속의 카페인 분석 UV-Visible Spectrophotometer
UV-Visible Spectrophotometer acetanilide와 benzoic acid 의 녹는점 측정 및 불순한 미지시료의 재결정
acetanilide와 benzoic acid 의 녹는점 측정 및 불순한 미지시료의 재결정 미지 시료 분석
미지 시료 분석 XRD를 이용한 미지의 시료 정량/정성 분석
XRD를 이용한 미지의 시료 정량/정성 분석 [화학실험] 몰비법을 이용한 착물의 화학식 결정 실험
[화학실험] 몰비법을 이용한 착물의 화학식 결정 실험 박층 크로마토그래피
박층 크로마토그래피 일반화학실험 - 중화적정을 통한 미지시료 농도 구하기
일반화학실험 - 중화적정을 통한 미지시료 농도 구하기 1. Chemical Unit & Concentration Titration(적정실험)
1. Chemical Unit & Concentration Titration(적정실험) [무기화학 및 분석화학 실험] 03[예비]. 과망간산칼륨(KMnO4) 용액의 조제 및 표정, EDTA표준...
[무기화학 및 분석화학 실험] 03[예비]. 과망간산칼륨(KMnO4) 용액의 조제 및 표정, EDTA표준... [무기화학 및 분석화학 실험] 03[결과]. 과망간산칼륨(KMnO4) 용액의 조제 및 표정, EDTA표준...
[무기화학 및 분석화학 실험] 03[결과]. 과망간산칼륨(KMnO4) 용액의 조제 및 표정, EDTA표준... 영양생화학실험A+)단백질의 정성반응 레포트
영양생화학실험A+)단백질의 정성반응 레포트



































소개글