본문내용
다.
Ⅴ. 실험 결과
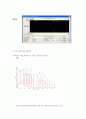
① Hyperchem을 이용한 분자의 IR spectrum
HCl
에탄올
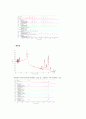
② 기체 시료의 IR 스펙트럼
(그래프의 x축은 진동수이고 y축은 absorbance이다.)
HCl
HCl이 라이브러리에 존재하는 표준 IR 그래프와 거의 일치하는 모습
에탄올
에탄올이 라이브러리에 존재하는 표준 IR 그래프와 거의 일치하는 모습
Ⅵ. 논의
①HCl
HCl 스펙트럼을 보면 각각의 peak가 2개로 갈라지는 것을 볼 수 있는데 이것은 Cl의 동위원소에 의한 것이다. peak 중 길이가 보다 긴 것은 35Cl에 의한 것이고, 보다 짧은 것은 37Cl에 의한 것이다. 35Cl에 의한 peak와 37Cl에 의한 peak 면적을 비교해보면 대략 4:1 정도가 나온다. 이 값은 자연계의 35Cl와 37Cl의 존재비율에 해당한다. 진동수를 구하기 위해 H35Cl과 H37Cl의 환상 질량을 계산해 실제 Spectrum data와 비교해보면, 2903과 2905의 비와 거의 일치한다.
(H35Cl)=0.9737, (H37Cl) = 0.9722 이다.
에 따라서 환산 질량에 따른 동위원소 분자의 진동수 비를 계산하면,
=
다음으로 HCl 스펙트럼의 또 다른 특징이 있는데 약 2880cm-1을 기준으로 대칭이다. 이것은 이원자 분자가 여러 level의 양자화된 회전에너지를 가지기 때문이다. 이원자 분자의 에너지 준위가 증가할 때 회전양자수 J가 증가하는 경우(J = +1) 에는 대칭축을 중심으로 스펙트럼의 왼쪽에 위치하고, 반대로 감소하는 경우에는 오른쪽에 위치한다.
우리의 IR data로 관성 모멘트 값을 구해보면, 에 의해 , 이 나온다.
각각을 의 식에 넣고, 평균값을 구해보면 약 1.304이 나온다. 이것을 의 식에 대입하면 약 이 나온다. 이론에서 배운 관성모멘트 값은으로 오차는 약 3.1%가 발생한다.
Hyperchem으로 구해보면 I의 값은 정도가 나오는데, 실험에 의한 것 보다는 비교적 정확한 편이다.
②에탄올
우리가 찍은 에탄올의 IR 데이터를 바탕으로 각 진동수에 해당하는 결합을 보면 다음과 같다.
진동수()
해당하는 결합
3600 부근
O-H 결합
2900 부근
C-H stretch
1000 부근
C-O bend
1500 부근
C-O-H bend
1500 부근
탄소 사슬 bend
Ⅶ. 오차, 반성
이번 실험에서 오차는 기체를 gas cell에 포집시킬 때 정확히 그 기체만 포집되지 않은 점이 가장 큰 원인인 것 같다. 이 외에도 IR 기계 상의 오차, 이물질의 유입 등이 그 이유가 될 수 있다.
이번 실험을 통해 IR을 이용하면 미지 시료의 이름을 알 수 있겠다는 생각이 들었다. 이 외에도 다양한 연구나 실험활동에서 IR이 유용하게 사용될 수 있을 것 같다.
Ⅷ. 참고자료
1) Principles of Modern Chemistry(6th Edition) Oxtoby/Gills/Campion 20.2장
2) http://blog.naver.com/ziziziwhdk?Redirect=Log&logNo=60092061579
Ⅴ. 실험 결과
① Hyperchem을 이용한 분자의 IR spectrum
HCl
에탄올
② 기체 시료의 IR 스펙트럼
(그래프의 x축은 진동수이고 y축은 absorbance이다.)
HCl
HCl이 라이브러리에 존재하는 표준 IR 그래프와 거의 일치하는 모습
에탄올
에탄올이 라이브러리에 존재하는 표준 IR 그래프와 거의 일치하는 모습
Ⅵ. 논의
①HCl
HCl 스펙트럼을 보면 각각의 peak가 2개로 갈라지는 것을 볼 수 있는데 이것은 Cl의 동위원소에 의한 것이다. peak 중 길이가 보다 긴 것은 35Cl에 의한 것이고, 보다 짧은 것은 37Cl에 의한 것이다. 35Cl에 의한 peak와 37Cl에 의한 peak 면적을 비교해보면 대략 4:1 정도가 나온다. 이 값은 자연계의 35Cl와 37Cl의 존재비율에 해당한다. 진동수를 구하기 위해 H35Cl과 H37Cl의 환상 질량을 계산해 실제 Spectrum data와 비교해보면, 2903과 2905의 비와 거의 일치한다.
(H35Cl)=0.9737, (H37Cl) = 0.9722 이다.
에 따라서 환산 질량에 따른 동위원소 분자의 진동수 비를 계산하면,
=
다음으로 HCl 스펙트럼의 또 다른 특징이 있는데 약 2880cm-1을 기준으로 대칭이다. 이것은 이원자 분자가 여러 level의 양자화된 회전에너지를 가지기 때문이다. 이원자 분자의 에너지 준위가 증가할 때 회전양자수 J가 증가하는 경우(J = +1) 에는 대칭축을 중심으로 스펙트럼의 왼쪽에 위치하고, 반대로 감소하는 경우에는 오른쪽에 위치한다.
우리의 IR data로 관성 모멘트 값을 구해보면, 에 의해 , 이 나온다.
각각을 의 식에 넣고, 평균값을 구해보면 약 1.304이 나온다. 이것을 의 식에 대입하면 약 이 나온다. 이론에서 배운 관성모멘트 값은으로 오차는 약 3.1%가 발생한다.
Hyperchem으로 구해보면 I의 값은 정도가 나오는데, 실험에 의한 것 보다는 비교적 정확한 편이다.
②에탄올
우리가 찍은 에탄올의 IR 데이터를 바탕으로 각 진동수에 해당하는 결합을 보면 다음과 같다.
진동수()
해당하는 결합
3600 부근
O-H 결합
2900 부근
C-H stretch
1000 부근
C-O bend
1500 부근
C-O-H bend
1500 부근
탄소 사슬 bend
Ⅶ. 오차, 반성
이번 실험에서 오차는 기체를 gas cell에 포집시킬 때 정확히 그 기체만 포집되지 않은 점이 가장 큰 원인인 것 같다. 이 외에도 IR 기계 상의 오차, 이물질의 유입 등이 그 이유가 될 수 있다.
이번 실험을 통해 IR을 이용하면 미지 시료의 이름을 알 수 있겠다는 생각이 들었다. 이 외에도 다양한 연구나 실험활동에서 IR이 유용하게 사용될 수 있을 것 같다.
Ⅷ. 참고자료
1) Principles of Modern Chemistry(6th Edition) Oxtoby/Gills/Campion 20.2장
2) http://blog.naver.com/ziziziwhdk?Redirect=Log&logNo=60092061579
추천자료
 전자회로실험 결과보고서-연산증폭기를 이용한 미분기와 적분기
전자회로실험 결과보고서-연산증폭기를 이용한 미분기와 적분기 전자회로실험 결과보고서- 연산증폭기를 이용한 반전증폭기와 비반전증폭기
전자회로실험 결과보고서- 연산증폭기를 이용한 반전증폭기와 비반전증폭기 전자회로실험 결과보고서-버터워스 2차 저역통과 능동필터
전자회로실험 결과보고서-버터워스 2차 저역통과 능동필터 현대물리실험, 리플탱크Ripple Tank실험 결과보고서
현대물리실험, 리플탱크Ripple Tank실험 결과보고서 철근콘크리트 역학실험 결과보고서 - 11.콘크리트의 배합설계
철근콘크리트 역학실험 결과보고서 - 11.콘크리트의 배합설계 토질역학실험 결과보고서 - #9.직접전단 시험(Direct-Shear)
토질역학실험 결과보고서 - #9.직접전단 시험(Direct-Shear) 토질역학실험 결과보고서 -#3.체 가름(Sieve Analysis) 완성
토질역학실험 결과보고서 -#3.체 가름(Sieve Analysis) 완성 일반화학 실험 결과보고서_불타지 않는 휴지와 지문 검사 실험
일반화학 실험 결과보고서_불타지 않는 휴지와 지문 검사 실험 실험02 결과보고서 과정1.고정된 경사각에서 시간-속도, 시간-거리
실험02 결과보고서 과정1.고정된 경사각에서 시간-속도, 시간-거리 물리학1실험 결과보고서#09.현의 진동
물리학1실험 결과보고서#09.현의 진동 물리학1실험 결과보고서#05.일과 에너지
물리학1실험 결과보고서#05.일과 에너지 일반 물리학 및 실험 힘의평형,길이의 측정 결과보고서
일반 물리학 및 실험 힘의평형,길이의 측정 결과보고서 기계공학응용실험 - 열전달 실험 결과보고서
기계공학응용실험 - 열전달 실험 결과보고서 기계공학응용실험 - 절삭력측정 링압축에 의한 소성마찰 측정실험 결과보고서
기계공학응용실험 - 절삭력측정 링압축에 의한 소성마찰 측정실험 결과보고서


























소개글