본문내용
- + H+
∴ Ka = [H+] 이고
pKa = pH = -log[H+]에서 가해준 염기량이 30ml일 때의 pH는 8.63이므로
8.63 = - log[H+] = pKa
Ka = 2.34 x
(인산)
NV = N′V′
N′ × 125ml = (0.1N × 37.0ml) -> 제 1 당량점
N′ = 2.96 × /3 = 9.87 x
※ 3을 나눠주는 이유는 인산의 당량수가 3이기 때문에 노르말농도를 몰농도로 변환시켜 주기 위함이다. ∵ nM = N (n은 당량수)
∴ Ka = [H+] 이고
pKa = pH = -log[H+]에서 가해준 염기량이 37ml일 때의 pH는 5.01이므로
5.01 = - log[H+] = pKa
Ka =9.77 x
NV = N′V′
N′ × 125ml = (0.1N × 74.25ml) -> 제 2 당량점
N′ = 5.94 × /3 = 1.98 x
∴ Ka = [H+] 이고
pKa = pH = -log[H+]에서 가해준 염기량이 74.5ml일 때의 pH는 8.68이므로
8.68 = - log[H+] = pKa
Ka =2,09 x
5. Discussion (분석 및 토의)
1.결과분석
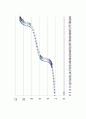
아세트산은 약산으로, CH3COOH → CH3COO- + H+ 와 같은 이온화 반응을 하게 된다. 이 반응에서 수소이온이 1개 얻어지므로 당량점을 얻는 실험을 그래프로 표현하면 pH가 급격히 증가하는 즉 변곡점이 한 개 얻어졌다. pH가 6.32부터 10.73 사이에서 급격한 변화를 보였으며, 그 사이 값을 구한 결과 pH는 8.63이라는 값이 나왔고, 그 값을 당량점으로 보고 Ka = 2.34 x 으로 계산되었다.
인산과 같은 경우 강산으로, H3PO4 +OH- -> H2PO4- + H2O 와 같은 반응이 한번 일어나고, H2PO4 +OH- + HPO4- + H2O 의 반응이 한 번 더 일어나서 당량점이 2개가 구해지는 특이한 경우였다.(본래 당량점이 3개이나 이번실험에서 구한 당량점은 2개 이므로 2개로 적었다.) pH가 급격히 증가하는 변곡점이 2개 얻어졌으며 pH가 3.73에서 5.66 사이에서 변곡점이 얻어져 그 사이의 값인 pH5.01을 당량점으로 정하였다. 그리고 pH가 7.87부터 10.55 까지 변곡점이 한 번 더 나타나 그 사이의 값인 pH 8.68인 지점을 제 2 당량점으로 보았다. 그리하여 제 1 당량점에서의 Ka =9.77 x 으로 결정 하고, 제 2당량점에서의 Ka =2,09 x 으로 결정짓고 실험을 마무리 하였다.
2.고찰 (실험 오차의 원인을 검토 해 보았다.)
(1) pH미터기 보정 시 전극 세척을 할 때 증류수로 충분히 세척을 하지 않아 오차가 생긴 것 같다. pH 미터를 보정할 때는 반드시 증류수로 세척을 한 후 종이로 조심스럽게 닦은 후 사용해야 되는데 그 과정에서 종이로 닦지 않고 바로 사용하였고, 증류수로 충분히 세척을 하지 않았다. 전극을 제대로 세척하지 않았다는 것은 정확한 기준 값부터 시작된 게 아니라는 뜻이 된다. 그대로 실험을 하게 되면 실험값들이 상당히 틀려 질 수가 있다.
(2) 아세트산 용액과 인산 용액을 만들 때 제대로 만들어 지지 않았을 것이다. 처음 아세트산 용액을 만들 때 피펫으로 아세트산을 취했는데, 피펫이 전 실험에서 잘 세척이 되지 않았는지 이물질이 많이 들어가 있었다. 그걸 모르고 부피플라스크에 담았었는데, 뒤늦게 눈치 채고 다 버린 다음 증류수로 씻고 다시 측정하였다. 부피플라스크를 씻는 과정에서 이물질이 다 씻겨 내려가지 않은 것 같다. 그리고 증류수가 묻어 있어서 정확하게 아세트산을 0.6g을 못 넣었거나 아니면 증류수를 가해줄때 정확하게 가해주지 못했을 것이다. 인산용액을 만들 때는 0.98g을 부피플라스크에 넣어야 되는데 처음에 너무 많이 초과해서 다시 버리고 한 적이 있다. 그 과정에서도 씻고 다시 하였는데 정확하게 부피를 맞추지 못해 용액의 농도가 달라진 것 같다. 그래서 초기 아세트산과 인산의 pH가 문헌의 값과 많이 달랐다.
(3) NaOH로 적정 시 뷰렛에서 염기를 가해줄 때 정확한 용량을 가해주지 않아서 오차가 생겼다. 뷰렛에서 1ml 또는 0.5ml 나 3ml를 가해줄 때 어떤 경우는 0.1ml나 0.2ml를 더 들어갔거나 혹은 덜 들어간 경우가 잦았다. 작은 실수라고 생각하고 넘어갔던 것이 후에 큰 오차를 유발한 것 같다. 또한 염기를 가해줄 때 산과 염기가 충분히 반응 할 수 있을 만큼 충분한 시간을 두고 일정간격으로 가해 줘야 되는데 염기를 넣을 때 너무 빨리 넣고 급하게 넣어서 오차가 생긴 것 같다. 인산의 같은 경우 제 1 당량점을 찾을 때 아세트산과 같이 엄청난 변화를 보인 것이 아니라 완만하게 보여서 찾기 힘들었다. 뷰렛에서 염기를 가해줄 때 조금 더 신중하게 가해줬더라면 찾기 쉬웠을 것이다.
(4) 실험과정에서의 실수도 있었겠지만 실험실 환경의 요인도 무시할 수 없을 것이다. 본래 실험이 완벽에 가깝게 나오기 위해서 이상적인 실험실이 필요했으나, 실험실 환경의 온도나, 습도 등이 영향을 끼쳤을 것이다.
3.결언
2학년 올라와 첫 실험이라 많이 긴장되고 설?다. 그래서 실험실에 들어와 정숙하거나 집중하는 모습을 보이지 못하였다. 또한 실험기구의 사용이나 용액을 만드는 것이 미숙하여 보기 좋은 모습을 보이지 못하였다. 앞으로 오차의 원인을 줄이기 위해서, 실험 시 밝은 분위기로 하는 것도 좋지만, 오차가 없기 위해 실험에 집중하고 진지한 모습을 보이는 것으로 실험의 정확도를 높이는 게 중요하다는 걸 깨닫고 다음실험에 임하겠다.
6. Reference (참고문헌)
(1) D.A. Skoog, D.M. West, F.J.Holler 저 - 전위차법 적정 - 분석화학 제6판 -
자유아카데미 - p430
(2) D.A. Skoog, D.M. West, F.J.Holler 저 - 유리전극의 pH 전위차법 측정 - 분석 화학 제6판 - 자유아카데미 - p427
(3) Gary D. Christian저 - 이용근 외 4명 역 - pH적정 - 분석화학 - 喜重堂 - p378
(4) 전위차 적정 및 이온화상수 결정 - 응용화공기초실험1 교재 - p46~50
∴ Ka = [H+] 이고
pKa = pH = -log[H+]에서 가해준 염기량이 30ml일 때의 pH는 8.63이므로
8.63 = - log[H+] = pKa
Ka = 2.34 x
(인산)
NV = N′V′
N′ × 125ml = (0.1N × 37.0ml) -> 제 1 당량점
N′ = 2.96 × /3 = 9.87 x
※ 3을 나눠주는 이유는 인산의 당량수가 3이기 때문에 노르말농도를 몰농도로 변환시켜 주기 위함이다. ∵ nM = N (n은 당량수)
∴ Ka = [H+] 이고
pKa = pH = -log[H+]에서 가해준 염기량이 37ml일 때의 pH는 5.01이므로
5.01 = - log[H+] = pKa
Ka =9.77 x
NV = N′V′
N′ × 125ml = (0.1N × 74.25ml) -> 제 2 당량점
N′ = 5.94 × /3 = 1.98 x
∴ Ka = [H+] 이고
pKa = pH = -log[H+]에서 가해준 염기량이 74.5ml일 때의 pH는 8.68이므로
8.68 = - log[H+] = pKa
Ka =2,09 x
5. Discussion (분석 및 토의)
1.결과분석
아세트산은 약산으로, CH3COOH → CH3COO- + H+ 와 같은 이온화 반응을 하게 된다. 이 반응에서 수소이온이 1개 얻어지므로 당량점을 얻는 실험을 그래프로 표현하면 pH가 급격히 증가하는 즉 변곡점이 한 개 얻어졌다. pH가 6.32부터 10.73 사이에서 급격한 변화를 보였으며, 그 사이 값을 구한 결과 pH는 8.63이라는 값이 나왔고, 그 값을 당량점으로 보고 Ka = 2.34 x 으로 계산되었다.
인산과 같은 경우 강산으로, H3PO4 +OH- -> H2PO4- + H2O 와 같은 반응이 한번 일어나고, H2PO4 +OH- + HPO4- + H2O 의 반응이 한 번 더 일어나서 당량점이 2개가 구해지는 특이한 경우였다.(본래 당량점이 3개이나 이번실험에서 구한 당량점은 2개 이므로 2개로 적었다.) pH가 급격히 증가하는 변곡점이 2개 얻어졌으며 pH가 3.73에서 5.66 사이에서 변곡점이 얻어져 그 사이의 값인 pH5.01을 당량점으로 정하였다. 그리고 pH가 7.87부터 10.55 까지 변곡점이 한 번 더 나타나 그 사이의 값인 pH 8.68인 지점을 제 2 당량점으로 보았다. 그리하여 제 1 당량점에서의 Ka =9.77 x 으로 결정 하고, 제 2당량점에서의 Ka =2,09 x 으로 결정짓고 실험을 마무리 하였다.
2.고찰 (실험 오차의 원인을 검토 해 보았다.)
(1) pH미터기 보정 시 전극 세척을 할 때 증류수로 충분히 세척을 하지 않아 오차가 생긴 것 같다. pH 미터를 보정할 때는 반드시 증류수로 세척을 한 후 종이로 조심스럽게 닦은 후 사용해야 되는데 그 과정에서 종이로 닦지 않고 바로 사용하였고, 증류수로 충분히 세척을 하지 않았다. 전극을 제대로 세척하지 않았다는 것은 정확한 기준 값부터 시작된 게 아니라는 뜻이 된다. 그대로 실험을 하게 되면 실험값들이 상당히 틀려 질 수가 있다.
(2) 아세트산 용액과 인산 용액을 만들 때 제대로 만들어 지지 않았을 것이다. 처음 아세트산 용액을 만들 때 피펫으로 아세트산을 취했는데, 피펫이 전 실험에서 잘 세척이 되지 않았는지 이물질이 많이 들어가 있었다. 그걸 모르고 부피플라스크에 담았었는데, 뒤늦게 눈치 채고 다 버린 다음 증류수로 씻고 다시 측정하였다. 부피플라스크를 씻는 과정에서 이물질이 다 씻겨 내려가지 않은 것 같다. 그리고 증류수가 묻어 있어서 정확하게 아세트산을 0.6g을 못 넣었거나 아니면 증류수를 가해줄때 정확하게 가해주지 못했을 것이다. 인산용액을 만들 때는 0.98g을 부피플라스크에 넣어야 되는데 처음에 너무 많이 초과해서 다시 버리고 한 적이 있다. 그 과정에서도 씻고 다시 하였는데 정확하게 부피를 맞추지 못해 용액의 농도가 달라진 것 같다. 그래서 초기 아세트산과 인산의 pH가 문헌의 값과 많이 달랐다.
(3) NaOH로 적정 시 뷰렛에서 염기를 가해줄 때 정확한 용량을 가해주지 않아서 오차가 생겼다. 뷰렛에서 1ml 또는 0.5ml 나 3ml를 가해줄 때 어떤 경우는 0.1ml나 0.2ml를 더 들어갔거나 혹은 덜 들어간 경우가 잦았다. 작은 실수라고 생각하고 넘어갔던 것이 후에 큰 오차를 유발한 것 같다. 또한 염기를 가해줄 때 산과 염기가 충분히 반응 할 수 있을 만큼 충분한 시간을 두고 일정간격으로 가해 줘야 되는데 염기를 넣을 때 너무 빨리 넣고 급하게 넣어서 오차가 생긴 것 같다. 인산의 같은 경우 제 1 당량점을 찾을 때 아세트산과 같이 엄청난 변화를 보인 것이 아니라 완만하게 보여서 찾기 힘들었다. 뷰렛에서 염기를 가해줄 때 조금 더 신중하게 가해줬더라면 찾기 쉬웠을 것이다.
(4) 실험과정에서의 실수도 있었겠지만 실험실 환경의 요인도 무시할 수 없을 것이다. 본래 실험이 완벽에 가깝게 나오기 위해서 이상적인 실험실이 필요했으나, 실험실 환경의 온도나, 습도 등이 영향을 끼쳤을 것이다.
3.결언
2학년 올라와 첫 실험이라 많이 긴장되고 설?다. 그래서 실험실에 들어와 정숙하거나 집중하는 모습을 보이지 못하였다. 또한 실험기구의 사용이나 용액을 만드는 것이 미숙하여 보기 좋은 모습을 보이지 못하였다. 앞으로 오차의 원인을 줄이기 위해서, 실험 시 밝은 분위기로 하는 것도 좋지만, 오차가 없기 위해 실험에 집중하고 진지한 모습을 보이는 것으로 실험의 정확도를 높이는 게 중요하다는 걸 깨닫고 다음실험에 임하겠다.
6. Reference (참고문헌)
(1) D.A. Skoog, D.M. West, F.J.Holler 저 - 전위차법 적정 - 분석화학 제6판 -
자유아카데미 - p430
(2) D.A. Skoog, D.M. West, F.J.Holler 저 - 유리전극의 pH 전위차법 측정 - 분석 화학 제6판 - 자유아카데미 - p427
(3) Gary D. Christian저 - 이용근 외 4명 역 - pH적정 - 분석화학 - 喜重堂 - p378
(4) 전위차 적정 및 이온화상수 결정 - 응용화공기초실험1 교재 - p46~50
추천자료
 시멘트의 정의와 종류, 제조공정.doc
시멘트의 정의와 종류, 제조공정.doc Sol-Gel 법에 의한 SiO₂Gel의 제조 실험 보고서
Sol-Gel 법에 의한 SiO₂Gel의 제조 실험 보고서 0.1 N- HCl 제조방법 및 특징
0.1 N- HCl 제조방법 및 특징 비누화 값 측정과 비누의 제조 결과보고서
비누화 값 측정과 비누의 제조 결과보고서 스킨 및 로션 화장품의 제조 및 평가 결과보고서
스킨 및 로션 화장품의 제조 및 평가 결과보고서 [화학실험] 비누제조 실험
[화학실험] 비누제조 실험 [생물학실험] 시약제조 및 멸균 실험
[생물학실험] 시약제조 및 멸균 실험 Slip casting을 이용한 고밀도 ZnO-Al2O3 제조
Slip casting을 이용한 고밀도 ZnO-Al2O3 제조 공업화학 기초실험 - 아스피린 제조
공업화학 기초실험 - 아스피린 제조 (식품가공학) 어묵 제조 실습
(식품가공학) 어묵 제조 실습 식품공학 실험 - 딸기잼 제조 방식 실험
식품공학 실험 - 딸기잼 제조 방식 실험 3주차 Alginate bead의 제조(결과) 망상형성 반응
3주차 Alginate bead의 제조(결과) 망상형성 반응
 화학공학[부가중합 폴리스티렌을 제조] 실험 결과 보고서
화학공학[부가중합 폴리스티렌을 제조] 실험 결과 보고서 1.Stearic Acid를 이용한 비누제조 (예비+결과)보고서
1.Stearic Acid를 이용한 비누제조 (예비+결과)보고서






























소개글