목차
실험 1. 화학 반응 속도
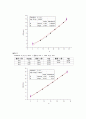
1. 결과 데이터
2. 결과 처리
1) 초기 반응 속도를 이용하기
2) 평균 기울기를 이용하기
3. 결과 분석
4. 토의
5. 출처
1. 결과 데이터
2. 결과 처리
1) 초기 반응 속도를 이용하기
2) 평균 기울기를 이용하기
3. 결과 분석
4. 토의
5. 출처
본문내용
있으므로 일차반응이라는 것을 알 수 있는데 초기 반응 속도를 이용했을 때의 속도상수 값과 평균 기울기를 이용했을 때의 속도상수 값이 다른 이유는 반응을 처음 시작할 때 빠르게 마개를 닫지 못해 기체가 외부로 세어나갔기 때문일 것이다. 따라서 실험 결과는 초기 반응 속도를 이용한 값보다 평균 기울기를 이용했을 때가 더 정확하다고 볼 수 있다.
4. 토의
결과 분석에도 썼듯이 반응속도에 영향을 미치는 요인은 반응물의 농도, 온도, 촉매의 유무와 촉매의 농도이다. 이번 실험에서는 반응물의 농도와 촉매의 농도를 조건으로 정해놓고 실험하였기 때문에 앞의 두 요인이 이번 실험에 반응을 미친 요인이 된다. 하지만 온도는 실험 A, B, C의 결과값이 거의 비슷한 것을 볼 때 별로 변화하지 않았으므로 이 실험에서 영향을 미치지 않은 요인으로 볼 수 있다.
n차 반응이라고 할 수 있는 것으로는 3가지를 들 수 있다. 첫 번째는 일차 반응(first-order reaction)이다. 일차 반응은 반응차수가 1인 화학반응을 가리킨다. 예를 들면 와 같은 반응에서 속도는 다음과 같다.
여기서 반응 속도는 의 농도의 1승에 비례하므로 이것은 일차반응이 된다.
n차 반응의 두 번째로는 이차반응(second-order reaction)이 있다. 이차 반응은 반응차수가 2인 화학반응으로 보통은 반응속도가 반응물의 농도의 2차식으로 표시되는 경우이다. 2차 반응의 예로는 를 들 수 있다. 이 식의 반응속도를 구해보면 다음과 같다.
이 반응은 따라서 2차 반응이 되는 것이다.
마지막 2차 반응은 영차반응(zero-order reaction)이다. 이러한 반응의 속도 법칙은 다음과 같다.
그러므로 이 반응은 농도에 따라 속도가 변하지 않아 영차반응이 된다.
위에서 살펴본 n차 반응은 모두 반응물이 하나로 이루어져 있었다. 하지만 모든 반응이 하나의 반응물로만 이루어진 것이 아니라 여러 개의 반응물로 이루어질 수도 있다. 라는 반응이 있을 때 이 반응물의 속도는 다음과 같다.
이 때 m과 n은 실험적으로 결정되는 값인데 이를 반응차수라고 하며 위의 경우 물질 A에 대해서는 m차 반응이고 물질 B에 대해서는 n차 반응이 되는 것이다. 전체 반응 차수는 (m+n)이 된다.
5. 출처
- 일반화학(Zumdahl, 화학교재연구회, 사이플러스, 2014.03.01.)
- 두산백과 인터넷 사전(http://www.doopedia.co.kr)
4. 토의
결과 분석에도 썼듯이 반응속도에 영향을 미치는 요인은 반응물의 농도, 온도, 촉매의 유무와 촉매의 농도이다. 이번 실험에서는 반응물의 농도와 촉매의 농도를 조건으로 정해놓고 실험하였기 때문에 앞의 두 요인이 이번 실험에 반응을 미친 요인이 된다. 하지만 온도는 실험 A, B, C의 결과값이 거의 비슷한 것을 볼 때 별로 변화하지 않았으므로 이 실험에서 영향을 미치지 않은 요인으로 볼 수 있다.
n차 반응이라고 할 수 있는 것으로는 3가지를 들 수 있다. 첫 번째는 일차 반응(first-order reaction)이다. 일차 반응은 반응차수가 1인 화학반응을 가리킨다. 예를 들면 와 같은 반응에서 속도는 다음과 같다.
여기서 반응 속도는 의 농도의 1승에 비례하므로 이것은 일차반응이 된다.
n차 반응의 두 번째로는 이차반응(second-order reaction)이 있다. 이차 반응은 반응차수가 2인 화학반응으로 보통은 반응속도가 반응물의 농도의 2차식으로 표시되는 경우이다. 2차 반응의 예로는 를 들 수 있다. 이 식의 반응속도를 구해보면 다음과 같다.
이 반응은 따라서 2차 반응이 되는 것이다.
마지막 2차 반응은 영차반응(zero-order reaction)이다. 이러한 반응의 속도 법칙은 다음과 같다.
그러므로 이 반응은 농도에 따라 속도가 변하지 않아 영차반응이 된다.
위에서 살펴본 n차 반응은 모두 반응물이 하나로 이루어져 있었다. 하지만 모든 반응이 하나의 반응물로만 이루어진 것이 아니라 여러 개의 반응물로 이루어질 수도 있다. 라는 반응이 있을 때 이 반응물의 속도는 다음과 같다.
이 때 m과 n은 실험적으로 결정되는 값인데 이를 반응차수라고 하며 위의 경우 물질 A에 대해서는 m차 반응이고 물질 B에 대해서는 n차 반응이 되는 것이다. 전체 반응 차수는 (m+n)이 된다.
5. 출처
- 일반화학(Zumdahl, 화학교재연구회, 사이플러스, 2014.03.01.)
- 두산백과 인터넷 사전(http://www.doopedia.co.kr)
추천자료
 화학 반응 속도 - 시계 반응
화학 반응 속도 - 시계 반응 화학평형 결과 보고서
화학평형 결과 보고서 일반화학실험 결과보고서 - 바륨의 원자량 결정
일반화학실험 결과보고서 - 바륨의 원자량 결정 일반화학실험 결과보고서 - 주스안의 비타민씨 정량
일반화학실험 결과보고서 - 주스안의 비타민씨 정량 일반화학실험 결과보고서 - Cyclodextrin을 이용한 형광의 증가
일반화학실험 결과보고서 - Cyclodextrin을 이용한 형광의 증가 화학 반응 속도
화학 반응 속도 실험 2. 화학 반응 속도
실험 2. 화학 반응 속도 [화학공학]고체로의 용액의 흡착실험 예비&결과보고서
[화학공학]고체로의 용액의 흡착실험 예비&결과보고서 분석화학실험5. Warder법을 이용한 NaOH 와 Na2CO3 혼합물의 정량실험결과보고서
분석화학실험5. Warder법을 이용한 NaOH 와 Na2CO3 혼합물의 정량실험결과보고서 [공학/컴퓨터/통신] 이중열 교환기(화학공학실험) 사전&결과보고서입니다.
[공학/컴퓨터/통신] 이중열 교환기(화학공학실험) 사전&결과보고서입니다. [화학실험] 시계반응 - 시계 반응을 이용해서 반응 속도의 차이가 큰 반응 단계가 연속적으로...
[화학실험] 시계반응 - 시계 반응을 이용해서 반응 속도의 차이가 큰 반응 단계가 연속적으로... 화학결과보고서 3장 아스피린의 합성
화학결과보고서 3장 아스피린의 합성 전자회로실험II - 실험 9. DC 모터 속도 제어 및 측정 제 1주 결과보고서
전자회로실험II - 실험 9. DC 모터 속도 제어 및 측정 제 1주 결과보고서


























소개글