|
서 칼슘이온이 침전되는 역반응이 일어난다. 결과적으로 농도가 더 높은 수산화나트륨 용액일 수록 더 적은 칼슘 이온 농도를 보였다.
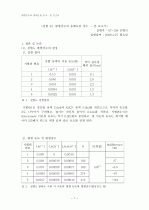
3). 각 용액에서의 용해도곱을 비교하고, 용해도곱이 상수임을 알아보자. 실험에서 얻은 값과 문헌에서 조
|
- 페이지 7페이지
- 가격 1,200원
- 등록일 2009.10.09
- 파일종류 한글(hwp)
- 참고문헌 있음
- 최근 2주 판매 이력 없음
|

|
용액을 만든다. 그리고 만약 흘렸을 경우에는 바로 휴지로 닦아낸다.
2) 의 양을 지나치게 많이 넣을 경우 깨끗하게 걸러지지 않으므로 적당한 양을 넣도록 한다.
3) 감압 거름 장치에서 나온 여과액을 취할 때 여과액이 절대로 묽혀져서는 안
|
- 페이지 4페이지
- 가격 1,500원
- 등록일 2009.11.29
- 파일종류 한글(hwp)
- 참고문헌 있음
- 최근 2주 판매 이력 없음
|

|
용해도 차이를 이용하여 전위차를 측정, 종말점을 구하여 미지시료 속의 두 혼합물의 질량을 분석할 수 있다.
여기서 이다. 그러므로 용해도곱상수가 작은 AgI가 먼저 형성되기 때문에 첫 번째 종말점은 AgI의 침전을, 두 번째 당량점은 KCl의
|
- 페이지 5페이지
- 가격 2,000원
- 등록일 2016.09.11
- 파일종류 한글(hwp)
- 참고문헌 없음
- 최근 2주 판매 이력 없음
|

|
크면 용해도곱 상수도 크다.
2) AgI(s), CuI(s), CaSO4(s)의 상대적 용해도의 순서는? (단 AgI(s)의 Ksp = 1.5 x 10-16,
CuI(s)의 Ksp = 5.0 x 10-12, CaSO4(s)의 Ksp = 6.1 x 10-5)
CaSO4(s) > CuI(s) > AgI(s)
3) 용해도는 침전을이용한 양이온의 정성분석에 어떻게 사용되는가?
|
- 페이지 4페이지
- 가격 1,400원
- 등록일 2007.02.28
- 파일종류 한글(hwp)
- 참고문헌 있음
- 최근 2주 판매 이력 없음
|

|
적정법
3) 폴하르트 법
부피 분석법
용해도곱 상수
르 샤틀리에의 원리
실험방법
참고문헌
실험 목적
침전 반응을 이용하여 염화물의 농도를 정량하고 Mohr법을 이해한다.
시약 및 기구
250ml 삼각 플라스크 (3개), 뷰렛, 자석 젓개, 자석 교반기, 0
|
- 페이지 8페이지
- 가격 6,300원
- 등록일 2015.07.28
- 파일종류 한글(hwp)
- 참고문헌 있음
- 최근 2주 판매 이력 없음
|