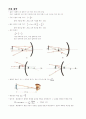목차
* 고전 역학
*회전 운동
*주기 운동
*유체 역학
*열 역학
*전자기학
*파동 역학
*현대 물리
*회전 운동
*주기 운동
*유체 역학
*열 역학
*전자기학
*파동 역학
*현대 물리
본문내용
therefore nu = {Z^2 R_H} over h left( 1 over n_f^2 - 1 over n_i^2 right)
.최소 파장 빛(최대E)이 방출 되는 경우
①시작 궤도가 같으면
n_f
작을수록 최소 파장이 방출된다.
②
n_i - n_f
값이 클수록? 틀린말
③
left( 1 over n_f^2 - 1 over n_i^2 right)
값이 클수록
시험에서는
R_H
값을 모르더라도 비례 이용해서 계산이 가능하도록 낸다.
ex. 수소 원자의 바닥 상태(n=1)의 에너지를 준다던가
.전자가 1개만 있는 원자에서 모두 적용된다. : H, He+, Li2+, Be3+
ex. Li2+ ion의 경우
Z = 3
이므로
r_2 = 4 over 3 a_0
E_2 = - 9 over 4 R_H
.드브로이의 물질파 이론 때문에 전자가 파동 운동을 해야하고 파동 함수에 의해서만 해석이 가능해 지면서 깨진다. 불과 10년만에 제자들에 의해 완전히 깨지지만 Bohr 연구소에서 양자역학을 태동시키도록 유도하였다.
드브로이 물질파
.1924년 프랑스의 Louis de Broglie : 운동하는 입자는 파동의 성질을 갖게 된다.
pf. 전자 빔의 회절 등
.
E=mc^2
m = E over c^2 = h over{ lambda c}
lambda = h over mv = h over p
where
p
는 운동량
.일상 수준에서는 느낄 수 없으나(
lambda =
too small)
원자내 전자의 경우는 문제됨(
lambda simeq 10^-10 m
)
.정상파(standing wave) : 배와 마디(node)가 있고 제자리에서 진동하는 것 매우 안정함
cf. 진행파(travelling wave)
.보어모델에서 만약 전자가 원운동을 한다면 방사선을 방출하며 E 잃어버리면서 핵에 충돌한다는 문제점(방사광 가속기에서 방출되는 x ray 처럼)이 있다. 그러므로 원운동 하지 않는다.
①전자의 물질파
lambda = h over {m_e v}
②정상파 조건
2 pi r = n lambda
therefore m_e v r = nh over 2pi
각운동량 양자화의 진정한 의미
③전자는 원운동하는 입자가 아니고 원궤도 상의 안정한 정상파이다.
Heisenberg의 불확정성 원리
.운동하는 물체의 위치와 운동량을 정확히 정하는 것은 불가능하다.
①우리가 측정하려면 운동량이나 위치는 알아야 하나를 바탕으로 우리가 준 운동량을 더하거나 빼서 다른 것을 계산할 수 있는데 둘 다 모를 때는 동시에 결정이 불가능하다.
②우리가 잴 수 있는 도구 자체가 양자화 되어있기 때문이다.
.1927년 Werner Heisenberg : 전자가 어디있고 그 궤도가 어떤지를 정확하게 규정할 수 없다. 최소 불확정성 존재
Deltax Delta p = m Deltax Deltav>= h over 4pi
정상파 조건에 의한 각운동량에서 n=1일 때의 절반
파동 함수
.원자내 전자의 위치는 파동함수로 나타내어야
.파동 함수
①공간상에 define된 확률 밀도함수로서 orbital이라 한다.
②파동함수의 위상이 그곳에 위치하고 있을 확률과 관련됨
③파동함수 수립을 위해 파동 방정식을 먼저 푼다.
④위치에 따른 존재 확률
propto
(파동함수의 진폭)2
비례한다고만 한 이유는 공간상에서 전부 적분하면 1이 되어야 하기 때문이다.
.오스트리아의 Erwin Schr dinger
①파동함수(오비탈) : 확률 밀도함수로서 제곱값이 주어진 공간에서 전자를 발견할 확률이다.
②파동 방정식 : 원자 내 전자위치에 대한 파동 함수를 세우기 위한 방정식
②해 : 에너지와 위치에 관한 경우의 수들이 나온다.
1차원 무한 포텐셜 우물에서의 파동 함수 계산
.파동 함수를
psi = A sin k x
로 놓자.
a
혹은
-a
인 점에서 확률은 0이 되어야 하므로
k = pi over L n
이어야 한다.
파동함수의 제곱은 확률 밀도 함수이므로
int_0^L psi^2 dx = 1
을 사용하여 A를 구한다.
A = sqrt {2 over L}
에너지 연산자를 적용하며 eigenvalue를 구하면
E = p^2 over 2m = {hbar^2 k^2} over 2m
이 된다.
E_n - E_n-1 = h^2 over 8mL^2 left( n^2 - (n-1)^2 right) = h^2 over 8mL^2 (2n-1)
대응 원리
.양자역학적 결과의 극한값이 고전역학적 결과와 같다.
.궤도의 개수가 한정되어있다고 보지 않고 무한개가 있다고 보거나
lim from n->inf DeltaE_n
플랑크 상수를 0으로 보내거나
lim from h->0 DeltaE_n
하는 기법을 쓴다.
.위의 무한 포텐셜 우물의 경우 대응 원리를 쓰면
-a
,
a
인 곳을 제외하고 모두 동일한 확률로 전자가 발견될 것이라는 결과를 얻는다.
전자스핀과 파울리의 베타원리
.선스펙트럼을 상세히 관찰 아주 근접한 2쌍의 스펙트럼 발견
네 번째 양자수
m_s
: 전자의 자전방향을 나타냄
+ 1 over 2
또는
- 1 over2
.1925년 오스트리아의 Wolfgang Pauli의 exclusion Principle
원자 안에 있는 두 개의 전자는 4개의 양자수가 모두 같을 수는 없다.
오비탈에는 전자가 2개 까지 들어갈 수 있다.
.Aufban의 원리
①낮은 에너지의 orbital부터 채운다.
②Pauli : 한 orbital에는 spin이 다른 두 개의 전자만을 채울 수 있다.
③Hund의 규칙 : 만일 여러개의 orbital이 같은 에너지 준위를 가지면(축퇴, degererate) 모든 orbital들이 채워질 때까지 한 개의 전자씩 채워들어간다. 이 때 하나씩 채워진 전자는 모두 같은 spin을 갖는다.
.예외
Cr : [Ar]4s23d4(x)
[Ar]4s13d5(o)
4s에 있는 전자를 에너지 준위가 비슷한 3d로 옮기면서 완전히 채워진 부껍질을 두 개의 반만 채워진 부껍질로 교환
Cu : [Ar]4s23d9(x)
[Ar]4s13d10(o)
이와 같은 현상은 부껍질 내의 전자-전자 반발력 때문이다.(pairing energy)
.최소 파장 빛(최대E)이 방출 되는 경우
①시작 궤도가 같으면
n_f
작을수록 최소 파장이 방출된다.
②
n_i - n_f
값이 클수록? 틀린말
③
left( 1 over n_f^2 - 1 over n_i^2 right)
값이 클수록
시험에서는
R_H
값을 모르더라도 비례 이용해서 계산이 가능하도록 낸다.
ex. 수소 원자의 바닥 상태(n=1)의 에너지를 준다던가
.전자가 1개만 있는 원자에서 모두 적용된다. : H, He+, Li2+, Be3+
ex. Li2+ ion의 경우
Z = 3
이므로
r_2 = 4 over 3 a_0
E_2 = - 9 over 4 R_H
.드브로이의 물질파 이론 때문에 전자가 파동 운동을 해야하고 파동 함수에 의해서만 해석이 가능해 지면서 깨진다. 불과 10년만에 제자들에 의해 완전히 깨지지만 Bohr 연구소에서 양자역학을 태동시키도록 유도하였다.
드브로이 물질파
.1924년 프랑스의 Louis de Broglie : 운동하는 입자는 파동의 성질을 갖게 된다.
pf. 전자 빔의 회절 등
.
E=mc^2
m = E over c^2 = h over{ lambda c}
lambda = h over mv = h over p
where
p
는 운동량
.일상 수준에서는 느낄 수 없으나(
lambda =
too small)
원자내 전자의 경우는 문제됨(
lambda simeq 10^-10 m
)
.정상파(standing wave) : 배와 마디(node)가 있고 제자리에서 진동하는 것 매우 안정함
cf. 진행파(travelling wave)
.보어모델에서 만약 전자가 원운동을 한다면 방사선을 방출하며 E 잃어버리면서 핵에 충돌한다는 문제점(방사광 가속기에서 방출되는 x ray 처럼)이 있다. 그러므로 원운동 하지 않는다.
①전자의 물질파
lambda = h over {m_e v}
②정상파 조건
2 pi r = n lambda
therefore m_e v r = nh over 2pi
각운동량 양자화의 진정한 의미
③전자는 원운동하는 입자가 아니고 원궤도 상의 안정한 정상파이다.
Heisenberg의 불확정성 원리
.운동하는 물체의 위치와 운동량을 정확히 정하는 것은 불가능하다.
①우리가 측정하려면 운동량이나 위치는 알아야 하나를 바탕으로 우리가 준 운동량을 더하거나 빼서 다른 것을 계산할 수 있는데 둘 다 모를 때는 동시에 결정이 불가능하다.
②우리가 잴 수 있는 도구 자체가 양자화 되어있기 때문이다.
.1927년 Werner Heisenberg : 전자가 어디있고 그 궤도가 어떤지를 정확하게 규정할 수 없다. 최소 불확정성 존재
Deltax Delta p = m Deltax Deltav>= h over 4pi
정상파 조건에 의한 각운동량에서 n=1일 때의 절반
파동 함수
.원자내 전자의 위치는 파동함수로 나타내어야
.파동 함수
①공간상에 define된 확률 밀도함수로서 orbital이라 한다.
②파동함수의 위상이 그곳에 위치하고 있을 확률과 관련됨
③파동함수 수립을 위해 파동 방정식을 먼저 푼다.
④위치에 따른 존재 확률
propto
(파동함수의 진폭)2
비례한다고만 한 이유는 공간상에서 전부 적분하면 1이 되어야 하기 때문이다.
.오스트리아의 Erwin Schr dinger
①파동함수(오비탈) : 확률 밀도함수로서 제곱값이 주어진 공간에서 전자를 발견할 확률이다.
②파동 방정식 : 원자 내 전자위치에 대한 파동 함수를 세우기 위한 방정식
②해 : 에너지와 위치에 관한 경우의 수들이 나온다.
1차원 무한 포텐셜 우물에서의 파동 함수 계산
.파동 함수를
psi = A sin k x
로 놓자.
a
혹은
-a
인 점에서 확률은 0이 되어야 하므로
k = pi over L n
이어야 한다.
파동함수의 제곱은 확률 밀도 함수이므로
int_0^L psi^2 dx = 1
을 사용하여 A를 구한다.
A = sqrt {2 over L}
에너지 연산자를 적용하며 eigenvalue를 구하면
E = p^2 over 2m = {hbar^2 k^2} over 2m
이 된다.
E_n - E_n-1 = h^2 over 8mL^2 left( n^2 - (n-1)^2 right) = h^2 over 8mL^2 (2n-1)
대응 원리
.양자역학적 결과의 극한값이 고전역학적 결과와 같다.
.궤도의 개수가 한정되어있다고 보지 않고 무한개가 있다고 보거나
lim from n->inf DeltaE_n
플랑크 상수를 0으로 보내거나
lim from h->0 DeltaE_n
하는 기법을 쓴다.
.위의 무한 포텐셜 우물의 경우 대응 원리를 쓰면
-a
,
a
인 곳을 제외하고 모두 동일한 확률로 전자가 발견될 것이라는 결과를 얻는다.
전자스핀과 파울리의 베타원리
.선스펙트럼을 상세히 관찰 아주 근접한 2쌍의 스펙트럼 발견
네 번째 양자수
m_s
: 전자의 자전방향을 나타냄
+ 1 over 2
또는
- 1 over2
.1925년 오스트리아의 Wolfgang Pauli의 exclusion Principle
원자 안에 있는 두 개의 전자는 4개의 양자수가 모두 같을 수는 없다.
오비탈에는 전자가 2개 까지 들어갈 수 있다.
.Aufban의 원리
①낮은 에너지의 orbital부터 채운다.
②Pauli : 한 orbital에는 spin이 다른 두 개의 전자만을 채울 수 있다.
③Hund의 규칙 : 만일 여러개의 orbital이 같은 에너지 준위를 가지면(축퇴, degererate) 모든 orbital들이 채워질 때까지 한 개의 전자씩 채워들어간다. 이 때 하나씩 채워진 전자는 모두 같은 spin을 갖는다.
.예외
Cr : [Ar]4s23d4(x)
[Ar]4s13d5(o)
4s에 있는 전자를 에너지 준위가 비슷한 3d로 옮기면서 완전히 채워진 부껍질을 두 개의 반만 채워진 부껍질로 교환
Cu : [Ar]4s23d9(x)
[Ar]4s13d10(o)
이와 같은 현상은 부껍질 내의 전자-전자 반발력 때문이다.(pairing energy)