목차
1. 서론
2. 이론
3. 실험장치 및 방법
4. 실험결과 및 고찰
5. 결론
6. 참고문헌
2. 이론
3. 실험장치 및 방법
4. 실험결과 및 고찰
5. 결론
6. 참고문헌
본문내용
nzoic acid
122.13
121-124(℃)
2-naphthol
144.17
121-123(℃)
urea
60.06
132-136(℃)
Cinnamic acid
148.16
132-135(℃)
(2) 순수한 화합물의 실험상의 녹는점
녹는점
화합물 종류
1회
2회
평 균
Benzoic acid
118℃
122℃
120℃
2-Naphthol
119℃
122℃
120.5℃
Urea
132℃
130℃
131℃
Cinnamic acid
131℃
132℃
131.5℃
대체적으로 측정값이 문헌의 값보다 작게 나왔다. 이는 우리가 측정을 할 때 약간 녹으려는 기미를 보이자마자 바로 그때가 녹는점인줄 알고 성급히 측정을 해서 인 듯싶다. 또한 미소하나마 불순물이 포함되어 있어서 녹는점의 값이 다르게 나타난 것 같고, 또한 실험 상 여러 가지 환경적 요인들이 작용하여 문헌 값과의 정확한 일치가 일어나지 않은 듯싶다.
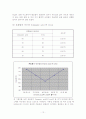
(3) 혼합물의 녹는점 (Cinnamic acid 와 Urea)
혼합물의 몰비(%)
녹는점
Cinnamic acid
Urea
90
10
118(℃)
70
30
110(℃)
50
50
102(℃)
30
70
110(℃)
10
90
118(℃)
위 그래프를 보면 공융점이 Cinnamic acid와 Urea의 몰 비가 50:50일 때이고, 그때의 녹는점의 온도는 102℃로 나타났다. 이론상 공융점은 몰 비가 5:5일 때 나타나는데 그것으로 본다면 이론상과 실험상이 일치하는 결과라고 볼 수 있다. 또한 각 혼합물의 몰 비를 달리 하였을 때 나오는 혼합물의 녹는점이 완벽한 대칭형의 결과를 얻었는데, 이는 실험상에 오차가 있을 것으로 예상되어진다. 순수한 물질 Cinnamic acid와 Urea는 132℃에서 135℃ 사이의 값인데, 혼합되어졌을 때에는 각 각 순수한 물질의 녹는점 보다 약 10℃ 가량 정도의 값이 적게 나오는 것으로 나타났다. 이는 혼합시의 분순물이 들어가기에 엔트로피가 증가하고 또한 분자간의 인력이 약해지기 때문인 것으로 예상되어진다.
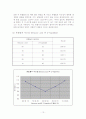
(4) 혼합물의 녹는점 (Benzoic acid 와 2-Naphthol)
혼합물의 몰비(%)
녹는점
Benzoic acid
2-Naphthol
90
10
108(℃)
70
30
101(℃)
50
50
95(℃)
30
70
101(℃)
10
90
109(℃)
위 그래프를 고찰하면, 위의 경우와 마찬가지로 혼합물의 몰 비가 50:50일 때 공융점을 나타내었고, 그 때의 녹는점은 95℃가 나왔다. 전체적인 데이터 값들이 위의 Cinnamic acid와 Urea의 혼합물의 경우보다 10℃ 가량 적게 나왔고, 또한 이론상 순수한 상태의 Benzoic acid와 2-Naphthol의 녹는점인 121℃에서 123℃사이의 온도보다도 10℃가량 적은 값이 나오는 것을 데이터와 그래프 상에서 확인 할 수 있다. 이 경우도 마찬가지로 혼합 시에 분자간의 인력이 약해지는 현상에서 이유를 찾을 수 있을 것이다.
5. 결론
우리는 이번 실험을 통해서 순수한 물질의 녹는점과 각각의 몰 비를 갖는 두 물질의 혼합물의 녹는점을 측정하여 각각의 phase diagram을 작성하고 공융점을 알아봄으로서 순수 물질과 혼합물질의 녹는점의 특성을 보고자 하는 것이었다.
먼저 우리는 순수한 물질의 녹는점을 살펴보고자 실험을 했는데 위에서 보았듯이 순수 물질의 녹는점의 측정에 있어서 문헌 값과의 약간의 오차를 보였다. 녹는점이란 온도의 변화가 일어나지 않은 채 액체상과 고체상이 서로 평형상태에 놓여 있는 온도로 정의된다. 녹는점에 있는 순수한 물질의 고체상과 액체상의 혼합물에 열을 가하면 고체가 모두 액체로 변할 때까지 온도는 높아지지 않는다. 따라서 물질의 녹는점을 확실히 확인하기 위해서는 온도상승도를 살펴보면 되는데 우리는 녹으려는 기미를 보이자마자 그때가 바로 녹는점이라 생각을 하고 그 값을 기록하였다. 또한 주변 환경적인 요인의 의해서 문헌 값에 비해 녹는점의 온도가 약간 낮게 측정되었다.
그리고 각각의 몰 비를 갖는 두 물질의 혼합물의 녹는점 측정했었는데, 먼저 Cinnamic acid와 Urea의 혼합물에서는 공융점이 몰 비가 5:5인 지점에서 나타났고, 이때의 녹는점 온도는 102℃로 나타났다. 또한 Benzoic acid와 2-Naphthol의 혼합물에서도 마찬가지로 공융점이 몰 비가 5:5일 때인 95℃로 나타났다. 두 경우의 혼합물의 몰 비는 같지만, 온도 상에서 차이가 나는데 이는 Cinnamic acid와 Urea의 순수 녹는점이 Benzoic acid와 2-Naphthol보다 거의 10℃ 가량 높은데서 이유를 찾을 수 있을 것이다. (문헌 값에서 확인했던 각각의 순수한 화합물의 녹는점은 Benzoic acid : 121℃-124℃, 2-naphthol : 121℃-123℃, urea : 132℃-136℃, Cinnamic acid : 132℃-135℃ 등이다.)
순수한 물질을 혼합할 때에 녹는점이 작게 나오는 이유는 여러 가지가 있겠지만, 이는 혼합시의 분순물이 들어가기에 엔트로피(무질서도)가 증가하고 또한 분자간의 인력이 약해지기 때문인 것으로 예상 되어진다.
우리는 이번 실험을 통해서 순수한 물질의 혼합 시에 녹는점이 떨어지는 것을 눈으로 확인 할 수 있었고, 어떤 혼합 몰 비로 섞이는 가에 따라서 녹는점이 더 낮아 질 수도 있고, 가장 낮은 녹는점을 보이는 공융점은 같은 몰 비 즉, 두 물질이면 5대 5로 섞었을 때 공융점이 나타난다는 결론을 이끌어 낼 수 있었다.
6. 참고문헌
전남대학교 공과대학 화학공학부 , “화학공학실험2”
이화영, 전해수, 조영일 공역 , “단위조작” , 한국맥그로힐(주) , 2001
김화용, 임경희, 여영구 공역 , “화학공학열역학(6판)” , 한국맥그로힐(주) , 2001
신재순, 이순기, 강춘형, 김영대 공역 , "핵심물리화학" , 교보문고 , 2003
(참고 site)
http://www.cheric.org/education/prop/mp.pdf
http://www.bueb125.com.ne.kr/san14-1.htm
http://www.chemmate.com/chem2/1/1-1-1.htm
122.13
121-124(℃)
2-naphthol
144.17
121-123(℃)
urea
60.06
132-136(℃)
Cinnamic acid
148.16
132-135(℃)
(2) 순수한 화합물의 실험상의 녹는점
녹는점
화합물 종류
1회
2회
평 균
Benzoic acid
118℃
122℃
120℃
2-Naphthol
119℃
122℃
120.5℃
Urea
132℃
130℃
131℃
Cinnamic acid
131℃
132℃
131.5℃
대체적으로 측정값이 문헌의 값보다 작게 나왔다. 이는 우리가 측정을 할 때 약간 녹으려는 기미를 보이자마자 바로 그때가 녹는점인줄 알고 성급히 측정을 해서 인 듯싶다. 또한 미소하나마 불순물이 포함되어 있어서 녹는점의 값이 다르게 나타난 것 같고, 또한 실험 상 여러 가지 환경적 요인들이 작용하여 문헌 값과의 정확한 일치가 일어나지 않은 듯싶다.
(3) 혼합물의 녹는점 (Cinnamic acid 와 Urea)
혼합물의 몰비(%)
녹는점
Cinnamic acid
Urea
90
10
118(℃)
70
30
110(℃)
50
50
102(℃)
30
70
110(℃)
10
90
118(℃)
위 그래프를 보면 공융점이 Cinnamic acid와 Urea의 몰 비가 50:50일 때이고, 그때의 녹는점의 온도는 102℃로 나타났다. 이론상 공융점은 몰 비가 5:5일 때 나타나는데 그것으로 본다면 이론상과 실험상이 일치하는 결과라고 볼 수 있다. 또한 각 혼합물의 몰 비를 달리 하였을 때 나오는 혼합물의 녹는점이 완벽한 대칭형의 결과를 얻었는데, 이는 실험상에 오차가 있을 것으로 예상되어진다. 순수한 물질 Cinnamic acid와 Urea는 132℃에서 135℃ 사이의 값인데, 혼합되어졌을 때에는 각 각 순수한 물질의 녹는점 보다 약 10℃ 가량 정도의 값이 적게 나오는 것으로 나타났다. 이는 혼합시의 분순물이 들어가기에 엔트로피가 증가하고 또한 분자간의 인력이 약해지기 때문인 것으로 예상되어진다.
(4) 혼합물의 녹는점 (Benzoic acid 와 2-Naphthol)
혼합물의 몰비(%)
녹는점
Benzoic acid
2-Naphthol
90
10
108(℃)
70
30
101(℃)
50
50
95(℃)
30
70
101(℃)
10
90
109(℃)
위 그래프를 고찰하면, 위의 경우와 마찬가지로 혼합물의 몰 비가 50:50일 때 공융점을 나타내었고, 그 때의 녹는점은 95℃가 나왔다. 전체적인 데이터 값들이 위의 Cinnamic acid와 Urea의 혼합물의 경우보다 10℃ 가량 적게 나왔고, 또한 이론상 순수한 상태의 Benzoic acid와 2-Naphthol의 녹는점인 121℃에서 123℃사이의 온도보다도 10℃가량 적은 값이 나오는 것을 데이터와 그래프 상에서 확인 할 수 있다. 이 경우도 마찬가지로 혼합 시에 분자간의 인력이 약해지는 현상에서 이유를 찾을 수 있을 것이다.
5. 결론
우리는 이번 실험을 통해서 순수한 물질의 녹는점과 각각의 몰 비를 갖는 두 물질의 혼합물의 녹는점을 측정하여 각각의 phase diagram을 작성하고 공융점을 알아봄으로서 순수 물질과 혼합물질의 녹는점의 특성을 보고자 하는 것이었다.
먼저 우리는 순수한 물질의 녹는점을 살펴보고자 실험을 했는데 위에서 보았듯이 순수 물질의 녹는점의 측정에 있어서 문헌 값과의 약간의 오차를 보였다. 녹는점이란 온도의 변화가 일어나지 않은 채 액체상과 고체상이 서로 평형상태에 놓여 있는 온도로 정의된다. 녹는점에 있는 순수한 물질의 고체상과 액체상의 혼합물에 열을 가하면 고체가 모두 액체로 변할 때까지 온도는 높아지지 않는다. 따라서 물질의 녹는점을 확실히 확인하기 위해서는 온도상승도를 살펴보면 되는데 우리는 녹으려는 기미를 보이자마자 그때가 바로 녹는점이라 생각을 하고 그 값을 기록하였다. 또한 주변 환경적인 요인의 의해서 문헌 값에 비해 녹는점의 온도가 약간 낮게 측정되었다.
그리고 각각의 몰 비를 갖는 두 물질의 혼합물의 녹는점 측정했었는데, 먼저 Cinnamic acid와 Urea의 혼합물에서는 공융점이 몰 비가 5:5인 지점에서 나타났고, 이때의 녹는점 온도는 102℃로 나타났다. 또한 Benzoic acid와 2-Naphthol의 혼합물에서도 마찬가지로 공융점이 몰 비가 5:5일 때인 95℃로 나타났다. 두 경우의 혼합물의 몰 비는 같지만, 온도 상에서 차이가 나는데 이는 Cinnamic acid와 Urea의 순수 녹는점이 Benzoic acid와 2-Naphthol보다 거의 10℃ 가량 높은데서 이유를 찾을 수 있을 것이다. (문헌 값에서 확인했던 각각의 순수한 화합물의 녹는점은 Benzoic acid : 121℃-124℃, 2-naphthol : 121℃-123℃, urea : 132℃-136℃, Cinnamic acid : 132℃-135℃ 등이다.)
순수한 물질을 혼합할 때에 녹는점이 작게 나오는 이유는 여러 가지가 있겠지만, 이는 혼합시의 분순물이 들어가기에 엔트로피(무질서도)가 증가하고 또한 분자간의 인력이 약해지기 때문인 것으로 예상 되어진다.
우리는 이번 실험을 통해서 순수한 물질의 혼합 시에 녹는점이 떨어지는 것을 눈으로 확인 할 수 있었고, 어떤 혼합 몰 비로 섞이는 가에 따라서 녹는점이 더 낮아 질 수도 있고, 가장 낮은 녹는점을 보이는 공융점은 같은 몰 비 즉, 두 물질이면 5대 5로 섞었을 때 공융점이 나타난다는 결론을 이끌어 낼 수 있었다.
6. 참고문헌
전남대학교 공과대학 화학공학부 , “화학공학실험2”
이화영, 전해수, 조영일 공역 , “단위조작” , 한국맥그로힐(주) , 2001
김화용, 임경희, 여영구 공역 , “화학공학열역학(6판)” , 한국맥그로힐(주) , 2001
신재순, 이순기, 강춘형, 김영대 공역 , "핵심물리화학" , 교보문고 , 2003
(참고 site)
http://www.cheric.org/education/prop/mp.pdf
http://www.bueb125.com.ne.kr/san14-1.htm
http://www.chemmate.com/chem2/1/1-1-1.htm


































소개글