목차
Ⅰ. 요약(Abstract)
Ⅱ. 서론(Introduction)
Ⅲ. 원리 및 방법(Theory & Methods)
Ⅳ. 결과(Result)
Ⅴ. 토의(Discussion)
Ⅵ. 참고(Reference)
Ⅱ. 서론(Introduction)
Ⅲ. 원리 및 방법(Theory & Methods)
Ⅳ. 결과(Result)
Ⅴ. 토의(Discussion)
Ⅵ. 참고(Reference)
본문내용
ver {left( 1 over T_25℃ - 1 over T_35℃ right)}
=~{-11.28 - (-10.90)} over {left( 1 over 298 - 1 over 308 right) }~=~underline-3.488×10^3
∴
E_a ~=~-3.488×10^3~ kJ/mol~×~8.3145~J/kmol
=~-2.900×10^4
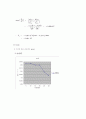
(3) Graph
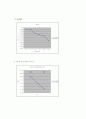
1) 시간에 따른 속도상수 graph
① At 25℃
② At 35℃
2) 온도에 따른 활성화 에너지
Ⅴ. 토의(Discussion)
이 실험에서는 NaOH의 농도를 정확히 하는 것이 실험에서의 오차를 제거하는 방법이 다. 그래서 우리는 NaOH의 농도를 알기 위해서 0.1M HCl로 표정을 해주었다. 하지만, 이때 0.1M로 만든 HCl의 농도를 정확히 0.1M라는 가정 하에 표정을 하였지만, 여기서 0.1M HCl이라고 만든 HCl의 농도가 정확히 0.1M가 아닐 수도 있다는 사실이다. 왜냐하면 0.1M라고 만든 NaOH도 표정 결과 농도는 0.091M 이었다. 그래서 NaOH의 농도 결정에 오차가 있었을 것이다.
또 표정을 위해서 사용한 지시약은 페놀프탈레인이었다. 페놀프탈레인의 변색 범위는 pH 8∼9정도이다. 약산(acetic acid)과 강염기(NaOH)의 적정에서는 염기성에서 종말점이 나타나므로 이 경우는 적당하다고 말할 수 있지만 강산(HCl)과 강염기(NaOH)의 표정에서는 종말점이 pH=7 정도에서 생성된다. 그래서 이 때 사용한 페놀프탈레인 지시약은 적당하지 못하다. 이 지시약을 사용하여 무색에서 붉은색으로 변하였을 때는 이미 그전부터 과량의 NaOH가 첨가되었으므로 표정을 통해 NaOH의 정확한 농도를 구할 수 없다.
그래서 변색범위가 pH=7 근처인 Bromothymol blue(pH 6.2-7.6)나 Phenol red(pH 6.8-8.4)를 사용해 주어야 할 것 같다.
※ 몇 가지 중요한 산/염기 지시약
관 용 명
변색범위(pH)
pKa
색깔 변화
Thymol blue
1.2∼2.8
1.65
R∼Y
8.0∼9.6
8.90
Y∼B
Methyl yellow
2.9∼4.0
R∼Y
Methyl orange
3.1∼4.4
3.46
R∼O
Bromocresol green
3.8∼5.4
4.66
Y∼B
Methyl red
4.2∼6.3
5.00
R∼Y
Bromocresol purple
5.2∼6.8
6.12
Y∼P
Bromothymol blue
6.2∼7.6
7.10
Y∼B
Phenol red
6.8∼8.4
7.81
Y∼R
Cresol purple
7.6∼9.2
Y∼P
Phenolphthalein
8.3∼10.0
C∼R
Thymolphthalein
9.3∼10.5
C∼B
Alizarin yellow GG
10∼12
C∼Y
(B-blue, C-coloress, O-orange, P-purple, R-red, Y-yellow)
이론에서 본 것과 같이 속도 상수(k)는 온도에 영향을 받는다. 실험 결과에서도 25℃에서보다 35℃에서 속도상수(k)가 증가함을 알 수 있었다. 즉, 온도가 큰 값을 가질수록 상수값은 큰 값을 갖고 이런 속도상수는 온도가 높다는 것은 높은 활성화 에너지를 가진 분자가 증가함을 의미한다.
Methyl acetate와 HCl을 5ml씩 flask에 넣고 일정시간 후에 그 시료를 채취해서 ice-bath에 담가서 계속 진행되고 있는 methyl acetate의 가수분해를 일시적으로 정지시키거나 늦춰서 종말점을 찾기 용이하도록 하는 방법으로 이것을 quenching이라 한다. 그리고 flask를 오랫동안 ice-bath에 담가 두었던 것이 그 온도에서 적정한 NaOH 양의 원래보다 감소하는 쪽으로 변화를 가져왔을 것이다. 또 시간에 따른 반응의 진척도를 통해서 반응속도를 결정하는 것이므로 일정시간 후 반복적으로 sample을 채취하여야만 정확한 rate를 구할 수 있다.
항온조에 sample들 담가서 열적 평형상태를 유지시켜서 실험을 해야만 그 온도에서의 속도변화를 알 수 있을 것이다.
계산 과정 중에서 Vs 값은 105ml이지만 104.6ml이다. 왜냐하면 이상용액이 아니기 때문이다. 그리고, 더 많은 온도 범위에서 하고 싶었지만 methyl acetate의 각 온도에 따른 밀도 값을 알 수 없어서 25℃와 35℃에서만 하였다.
Ⅵ. 참고(Reference)
① 물리화학실험, 대한화학회, 청문각
② 물리화학, 서교택 외, 자유아카데미
③ 물리화학, 박병각 외, 탐구당
=~{-11.28 - (-10.90)} over {left( 1 over 298 - 1 over 308 right) }~=~underline-3.488×10^3
∴
E_a ~=~-3.488×10^3~ kJ/mol~×~8.3145~J/kmol
=~-2.900×10^4
(3) Graph
1) 시간에 따른 속도상수 graph
① At 25℃
② At 35℃
2) 온도에 따른 활성화 에너지
Ⅴ. 토의(Discussion)
이 실험에서는 NaOH의 농도를 정확히 하는 것이 실험에서의 오차를 제거하는 방법이 다. 그래서 우리는 NaOH의 농도를 알기 위해서 0.1M HCl로 표정을 해주었다. 하지만, 이때 0.1M로 만든 HCl의 농도를 정확히 0.1M라는 가정 하에 표정을 하였지만, 여기서 0.1M HCl이라고 만든 HCl의 농도가 정확히 0.1M가 아닐 수도 있다는 사실이다. 왜냐하면 0.1M라고 만든 NaOH도 표정 결과 농도는 0.091M 이었다. 그래서 NaOH의 농도 결정에 오차가 있었을 것이다.
또 표정을 위해서 사용한 지시약은 페놀프탈레인이었다. 페놀프탈레인의 변색 범위는 pH 8∼9정도이다. 약산(acetic acid)과 강염기(NaOH)의 적정에서는 염기성에서 종말점이 나타나므로 이 경우는 적당하다고 말할 수 있지만 강산(HCl)과 강염기(NaOH)의 표정에서는 종말점이 pH=7 정도에서 생성된다. 그래서 이 때 사용한 페놀프탈레인 지시약은 적당하지 못하다. 이 지시약을 사용하여 무색에서 붉은색으로 변하였을 때는 이미 그전부터 과량의 NaOH가 첨가되었으므로 표정을 통해 NaOH의 정확한 농도를 구할 수 없다.
그래서 변색범위가 pH=7 근처인 Bromothymol blue(pH 6.2-7.6)나 Phenol red(pH 6.8-8.4)를 사용해 주어야 할 것 같다.
※ 몇 가지 중요한 산/염기 지시약
관 용 명
변색범위(pH)
pKa
색깔 변화
Thymol blue
1.2∼2.8
1.65
R∼Y
8.0∼9.6
8.90
Y∼B
Methyl yellow
2.9∼4.0
R∼Y
Methyl orange
3.1∼4.4
3.46
R∼O
Bromocresol green
3.8∼5.4
4.66
Y∼B
Methyl red
4.2∼6.3
5.00
R∼Y
Bromocresol purple
5.2∼6.8
6.12
Y∼P
Bromothymol blue
6.2∼7.6
7.10
Y∼B
Phenol red
6.8∼8.4
7.81
Y∼R
Cresol purple
7.6∼9.2
Y∼P
Phenolphthalein
8.3∼10.0
C∼R
Thymolphthalein
9.3∼10.5
C∼B
Alizarin yellow GG
10∼12
C∼Y
(B-blue, C-coloress, O-orange, P-purple, R-red, Y-yellow)
이론에서 본 것과 같이 속도 상수(k)는 온도에 영향을 받는다. 실험 결과에서도 25℃에서보다 35℃에서 속도상수(k)가 증가함을 알 수 있었다. 즉, 온도가 큰 값을 가질수록 상수값은 큰 값을 갖고 이런 속도상수는 온도가 높다는 것은 높은 활성화 에너지를 가진 분자가 증가함을 의미한다.
Methyl acetate와 HCl을 5ml씩 flask에 넣고 일정시간 후에 그 시료를 채취해서 ice-bath에 담가서 계속 진행되고 있는 methyl acetate의 가수분해를 일시적으로 정지시키거나 늦춰서 종말점을 찾기 용이하도록 하는 방법으로 이것을 quenching이라 한다. 그리고 flask를 오랫동안 ice-bath에 담가 두었던 것이 그 온도에서 적정한 NaOH 양의 원래보다 감소하는 쪽으로 변화를 가져왔을 것이다. 또 시간에 따른 반응의 진척도를 통해서 반응속도를 결정하는 것이므로 일정시간 후 반복적으로 sample을 채취하여야만 정확한 rate를 구할 수 있다.
항온조에 sample들 담가서 열적 평형상태를 유지시켜서 실험을 해야만 그 온도에서의 속도변화를 알 수 있을 것이다.
계산 과정 중에서 Vs 값은 105ml이지만 104.6ml이다. 왜냐하면 이상용액이 아니기 때문이다. 그리고, 더 많은 온도 범위에서 하고 싶었지만 methyl acetate의 각 온도에 따른 밀도 값을 알 수 없어서 25℃와 35℃에서만 하였다.
Ⅵ. 참고(Reference)
① 물리화학실험, 대한화학회, 청문각
② 물리화학, 서교택 외, 자유아카데미
③ 물리화학, 박병각 외, 탐구당