목차
1. 서론
2. 이론
2-1. 분석방법의 종류
2-2. 시료채취 방법
2-3. 시약 및 제조 방법
3. 실험 방법
3-1. 실험 기구
3-2. 실험 시약
3-3. 실험 방법
4. 결과 및 논의
4-1. Raw data
4-2. 결과
4-3. 논의
5. 결론
*참고문헌
2. 이론
2-1. 분석방법의 종류
2-2. 시료채취 방법
2-3. 시약 및 제조 방법
3. 실험 방법
3-1. 실험 기구
3-2. 실험 시약
3-3. 실험 방법
4. 결과 및 논의
4-1. Raw data
4-2. 결과
4-3. 논의
5. 결론
*참고문헌
본문내용
식에 의해 염화수소 농도 를 구할 수 없다.
- 메틸알코올을 첨가함으로써 Rambert-Beer의 법칙에 따라 검량선은 원점을 통과 하는 직선이 된다.
(2) 황산제이철암모늄 용액
황산제이철암모늄 용액 6.0g + 과염소산(1+2) 100㎖
※주의 : 황산제이철암모늄 6수화물은 (약간 고운 결정체로서 푸른색을 띰) 발색이 안 되므로 필히 12수화물 (큰 결정체로서 보라색을 띰)을 사용
(3) NaOH 흡수액
NaOH 0.4g + 증류수 ⇒ 100㎖
♣ 이므로 100㎖당 0.4g 이 들어있으므로 이다.
(4) 과염소산(1+2)
과염소산(70%) 1에 증류수 2를 가한다.
※ 과염소산(60%) 2에 증류수 3을 가한다. (과염소산(2+3))
(5) 염소이온 표준액
염화나트륨(NaCl) 0.0261g + 증류수 ⇒ 100㎖
염소이온 표준액 1㎖ = 0.01㎖ HCl ( 0℃, 1atm )
3. 실험 방법
3-1. 실험 기구
▩ 유리마개가 있는 시험관
▩ 피펫
▩ 유리 여과기
▩ 핸드 에어 샘플러
▩ 임핀저
▩ 석영셀
3-2. 사용 시약
▩ 증류수 (Distilled Water) : H20
▩ 염소이온 용액 : 염화나트륨(용량분석용 표준시약 NaCl) + 증류수
▩ 티오시안산 제 2수은용액
- 티오시안산 제 2수은 (Mercury Ⅱ Thiocyanate) :
- 메틸알코올 (Methyl alcohol or Methanol) :
▩ 황산 제 2철 암모늄용액
- 황산 제 2철 암모늄 (Ammonium Iron Ⅲ Sulfate dodecahydrate)
:
▩ 과염소산(1+2) : 과염소산 (Perchloric Acid) :
3-3. 실험 방법
① 흡수액과 염소이온 표준액을 다음과 같은 배율로 시험관에 취한다.
표준시료번호
A
B
C
D
E
표준액(㎖)
0
0.5
1
1.5
2
흡수액(㎖)
5
4.5
4
3.5
3
㎖HCl(gas)
/㎖(흡수액)
0
0.001
0.002
0.003
0.004
② 분석용 시료용액 5㎖를 시험관에 취한다.
③ ①, ②에 황산제이철암모늄 용액 2㎖를 가한다.
④ ①, ②에 티오시안산제이수은 용액 1㎖를 가한다.
⑤ ①, ②에 메틸알코올 10㎖를 가한다.
⑥ 발색 후 흡광도를 측정한다.
4. 결과 및 논의
4-1. Raw data
(1) 염화수소 농도 구하는 식
C = 염화수소 농도
A = 분석용 시료 용액을 발색시켜 측정한 흡광도
AS = 표준액을 발색시켜 측정한 흡광도
VS = 총 가스량
(2) 시료량 구하는 식
VS = 흡인속도 X 흡인시간 X 흡인온도 X 흡인압력
(3) 흡수액 1㎖당 염화수소(㎖) 구하기
흡수액 1㎖당 염화수소(㎖) 구하기 =
4-2. 결과
(1) 흡광도 값 및 흡수액 1㎖당 염화수소(㎖)
표준시료번호
A
B
C
D
E
미지시료
㎖HCl(gas)
/㎖(흡수액)
0
0.001
0.002
0.003
0.004
흡광도 값
0
0.516
0.811
1.092
1.293
0.610
★ 흡수액 1㎖당 염화수소(㎖) 구하기
1) A
2) B
3) C
4) D
5) E
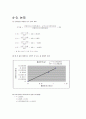
(2) 엑셀 이용한 검량선 그래프 그리기
( X : 흡광도값 , Y : 흡수액 1㎖당 염화수소(㎖) )
★ 가스 유량 구하기
VS =
★ 1㎖ 용액당 미지시료의 염화수소량(㎖)
Y = 0.0031X - 0.0003
= 0.0031 x 0.610 - 0.003
= 0.001591㎖ 염화수소/ ㎖용액
★ 포집된 총 염화수소 양 ( ㎖, gas )
포집된 총 염화수소 양 = 미지시료 1㎖ 용액당 염화수소량(㎖) X 총 흡수액 부피(㎖)
= 0.001591㎖ 염화수소/ ㎖용액 x 100㎖
=0.1591㎖염화수소
★ 배가스 내 염화수소 농도
(3) 공식 이용해서 염화수소 농도 구하기
1) B
2) C
3) D
4) E
★ 엑셀을 이용한 염화수소 농도 그래프
4-3. 논의
(1) 검량선을 이용한 농도 값의 차이
① B :
② C :
③ D :
④ E :
∴ B, E의 차이가 가장 크게 나타남.
(2) B, E 값을 제외하고 검량식 및 농도 값 재계산 결과
★ 1㎖ 용액당 미지시료의 염화수소량(㎖)
Y = 0.0026X
= 0.0026 x 0.610
= 0.001586㎖염화수소/㎖용액
★ 포집된 총 염화수소 양 ( ㎖, gas )
포집된 총 염화수소 양 = 미지시료 1㎖ 용액당 염화수소량(㎖) X 총 흡수액 부피(㎖)
= 0.001586㎖ 염화수소/ ㎖용액 x 100㎖
= 0.1586㎖ 염화수소
★ 배가스 내 염화수소 농도
★ 공식 이용해서 염화수소 농도 구하기
1) C
2) D
⇒ 평균농도 : 2.47ppm
★ 검량선을 이용한 농도 값의 차이
① C :
② D :
∴ ± 5% 범위내에서 농도의 차이가 나타남.
5. 결론
실험을 통하여 오염원인 염화수소 함량 분석을 이해할 수 있었다.
염화수소는 오염원의 한 원인으로써 인체에 튼 영향을 끼친다. 피부접촉 시에는 염증(가려움, 통증)을 일으키고, 눈과 접촉시에는 시력감퇴 또는 시력상실의 우려가 있으며, 결막염을 일으키고 염화수소의 존재시 오랜시간 작업하면 치아가 부식된다. 염산을 삼키면 구토, 위통을 느낀다. 진한 염산가스인 경우 들어마시면 기침이 나거나 코나 목에 염증을 유발함. 묽은 염산은 대개 피해가 적다고 하지만 장기간 염산의 증기 등에 접하면 치아가 부식되고 위험성도 따른다. 많은 양을 흡입하면 폐수종으로 사망. 진한 가스나 증기를 흡입하면 인체의 조직을 손상시키고 목의 통증이나 경련을 일으켜 사망하는 수가 있다.
그래서 최근엔 대기 오염의 심각성을 반영하듯 대기환경보전법 시행규칙 주요 개정내용을 보면 2010년부터 사업장의 대기오염물질 배출허용기준이 대폭 강화된다. 황산화물(SOx), 질소산화물(NOx), 암모니아, 염화수소, 먼지 등 주요 대기오염물질의 배출허용기준을 현행보다 10~50% 강화한다는 것이다. 하지만 현실적으로 배출허용기준 준수가 어려운 시멘트소성시설의 염화수소(HCl) 기준은 완화된다고 한다. 굴뚝 등에서 배출되는 염화수소의 정확한 측정을 통해 좀 더 강화된 기준을 만들 수 있길 바란다.
*참고문헌
1. 대기 환경기사
2. 네이버 지식 검색
3. 인터넷 뉴스 기사 참조
- 메틸알코올을 첨가함으로써 Rambert-Beer의 법칙에 따라 검량선은 원점을 통과 하는 직선이 된다.
(2) 황산제이철암모늄 용액
황산제이철암모늄 용액 6.0g + 과염소산(1+2) 100㎖
※주의 : 황산제이철암모늄 6수화물은 (약간 고운 결정체로서 푸른색을 띰) 발색이 안 되므로 필히 12수화물 (큰 결정체로서 보라색을 띰)을 사용
(3) NaOH 흡수액
NaOH 0.4g + 증류수 ⇒ 100㎖
♣ 이므로 100㎖당 0.4g 이 들어있으므로 이다.
(4) 과염소산(1+2)
과염소산(70%) 1에 증류수 2를 가한다.
※ 과염소산(60%) 2에 증류수 3을 가한다. (과염소산(2+3))
(5) 염소이온 표준액
염화나트륨(NaCl) 0.0261g + 증류수 ⇒ 100㎖
염소이온 표준액 1㎖ = 0.01㎖ HCl ( 0℃, 1atm )
3. 실험 방법
3-1. 실험 기구
▩ 유리마개가 있는 시험관
▩ 피펫
▩ 유리 여과기
▩ 핸드 에어 샘플러
▩ 임핀저
▩ 석영셀
3-2. 사용 시약
▩ 증류수 (Distilled Water) : H20
▩ 염소이온 용액 : 염화나트륨(용량분석용 표준시약 NaCl) + 증류수
▩ 티오시안산 제 2수은용액
- 티오시안산 제 2수은 (Mercury Ⅱ Thiocyanate) :
- 메틸알코올 (Methyl alcohol or Methanol) :
▩ 황산 제 2철 암모늄용액
- 황산 제 2철 암모늄 (Ammonium Iron Ⅲ Sulfate dodecahydrate)
:
▩ 과염소산(1+2) : 과염소산 (Perchloric Acid) :
3-3. 실험 방법
① 흡수액과 염소이온 표준액을 다음과 같은 배율로 시험관에 취한다.
표준시료번호
A
B
C
D
E
표준액(㎖)
0
0.5
1
1.5
2
흡수액(㎖)
5
4.5
4
3.5
3
㎖HCl(gas)
/㎖(흡수액)
0
0.001
0.002
0.003
0.004
② 분석용 시료용액 5㎖를 시험관에 취한다.
③ ①, ②에 황산제이철암모늄 용액 2㎖를 가한다.
④ ①, ②에 티오시안산제이수은 용액 1㎖를 가한다.
⑤ ①, ②에 메틸알코올 10㎖를 가한다.
⑥ 발색 후 흡광도를 측정한다.
4. 결과 및 논의
4-1. Raw data
(1) 염화수소 농도 구하는 식
C = 염화수소 농도
A = 분석용 시료 용액을 발색시켜 측정한 흡광도
AS = 표준액을 발색시켜 측정한 흡광도
VS = 총 가스량
(2) 시료량 구하는 식
VS = 흡인속도 X 흡인시간 X 흡인온도 X 흡인압력
(3) 흡수액 1㎖당 염화수소(㎖) 구하기
흡수액 1㎖당 염화수소(㎖) 구하기 =
4-2. 결과
(1) 흡광도 값 및 흡수액 1㎖당 염화수소(㎖)
표준시료번호
A
B
C
D
E
미지시료
㎖HCl(gas)
/㎖(흡수액)
0
0.001
0.002
0.003
0.004
흡광도 값
0
0.516
0.811
1.092
1.293
0.610
★ 흡수액 1㎖당 염화수소(㎖) 구하기
1) A
2) B
3) C
4) D
5) E
(2) 엑셀 이용한 검량선 그래프 그리기
( X : 흡광도값 , Y : 흡수액 1㎖당 염화수소(㎖) )
★ 가스 유량 구하기
VS =
★ 1㎖ 용액당 미지시료의 염화수소량(㎖)
Y = 0.0031X - 0.0003
= 0.0031 x 0.610 - 0.003
= 0.001591㎖ 염화수소/ ㎖용액
★ 포집된 총 염화수소 양 ( ㎖, gas )
포집된 총 염화수소 양 = 미지시료 1㎖ 용액당 염화수소량(㎖) X 총 흡수액 부피(㎖)
= 0.001591㎖ 염화수소/ ㎖용액 x 100㎖
=0.1591㎖염화수소
★ 배가스 내 염화수소 농도
(3) 공식 이용해서 염화수소 농도 구하기
1) B
2) C
3) D
4) E
★ 엑셀을 이용한 염화수소 농도 그래프
4-3. 논의
(1) 검량선을 이용한 농도 값의 차이
① B :
② C :
③ D :
④ E :
∴ B, E의 차이가 가장 크게 나타남.
(2) B, E 값을 제외하고 검량식 및 농도 값 재계산 결과
★ 1㎖ 용액당 미지시료의 염화수소량(㎖)
Y = 0.0026X
= 0.0026 x 0.610
= 0.001586㎖염화수소/㎖용액
★ 포집된 총 염화수소 양 ( ㎖, gas )
포집된 총 염화수소 양 = 미지시료 1㎖ 용액당 염화수소량(㎖) X 총 흡수액 부피(㎖)
= 0.001586㎖ 염화수소/ ㎖용액 x 100㎖
= 0.1586㎖ 염화수소
★ 배가스 내 염화수소 농도
★ 공식 이용해서 염화수소 농도 구하기
1) C
2) D
⇒ 평균농도 : 2.47ppm
★ 검량선을 이용한 농도 값의 차이
① C :
② D :
∴ ± 5% 범위내에서 농도의 차이가 나타남.
5. 결론
실험을 통하여 오염원인 염화수소 함량 분석을 이해할 수 있었다.
염화수소는 오염원의 한 원인으로써 인체에 튼 영향을 끼친다. 피부접촉 시에는 염증(가려움, 통증)을 일으키고, 눈과 접촉시에는 시력감퇴 또는 시력상실의 우려가 있으며, 결막염을 일으키고 염화수소의 존재시 오랜시간 작업하면 치아가 부식된다. 염산을 삼키면 구토, 위통을 느낀다. 진한 염산가스인 경우 들어마시면 기침이 나거나 코나 목에 염증을 유발함. 묽은 염산은 대개 피해가 적다고 하지만 장기간 염산의 증기 등에 접하면 치아가 부식되고 위험성도 따른다. 많은 양을 흡입하면 폐수종으로 사망. 진한 가스나 증기를 흡입하면 인체의 조직을 손상시키고 목의 통증이나 경련을 일으켜 사망하는 수가 있다.
그래서 최근엔 대기 오염의 심각성을 반영하듯 대기환경보전법 시행규칙 주요 개정내용을 보면 2010년부터 사업장의 대기오염물질 배출허용기준이 대폭 강화된다. 황산화물(SOx), 질소산화물(NOx), 암모니아, 염화수소, 먼지 등 주요 대기오염물질의 배출허용기준을 현행보다 10~50% 강화한다는 것이다. 하지만 현실적으로 배출허용기준 준수가 어려운 시멘트소성시설의 염화수소(HCl) 기준은 완화된다고 한다. 굴뚝 등에서 배출되는 염화수소의 정확한 측정을 통해 좀 더 강화된 기준을 만들 수 있길 바란다.
*참고문헌
1. 대기 환경기사
2. 네이버 지식 검색
3. 인터넷 뉴스 기사 참조
추천자료
 *원자흡수분광법(Atomic Absorption Spectrometry)
*원자흡수분광법(Atomic Absorption Spectrometry) 수소이야기
수소이야기 기기분석 플라즈마에 대해
기기분석 플라즈마에 대해 요오드 이온촉매에 의한 과산화수소 분해반응
요오드 이온촉매에 의한 과산화수소 분해반응 공업용 염화나트륨중의 염화나트륨의 정량(티오시안산(볼하르법))
공업용 염화나트륨중의 염화나트륨의 정량(티오시안산(볼하르법)) 간장중의 염화나트륨 정량
간장중의 염화나트륨 정량 수소이온농도와 지시약
수소이온농도와 지시약 [일반화학실험][예비+결과] 인산의 적정과 완충용액 실험
[일반화학실험][예비+결과] 인산의 적정과 완충용액 실험 일반화학실험_NMR 실험방법 및 보고서
일반화학실험_NMR 실험방법 및 보고서 [화학실험] 혼합물의 정량[수산화나트륨, 탄산나트륨 혼합물의 정량] - 실험목적, 이론, 기구...
[화학실험] 혼합물의 정량[수산화나트륨, 탄산나트륨 혼합물의 정량] - 실험목적, 이론, 기구... PH미터에 의한 수소 이온 농도의 측정 [예비]
PH미터에 의한 수소 이온 농도의 측정 [예비] [일반화학실험] 산염기의 적정 실험
[일반화학실험] 산염기의 적정 실험 무기화학실험보고서-[Co(NH)Cl]Cl의 합성
무기화학실험보고서-[Co(NH)Cl]Cl의 합성 무기화학실험보고서 - [Co(NH)Cl]Cl 합성 결과 보고서
무기화학실험보고서 - [Co(NH)Cl]Cl 합성 결과 보고서