본문내용
되고 잇으며, 반응 혼합물 중의 한 물질이 측정 가능한 스펙트럼 영역에서 센 고유 흡수를 일으키는 경우에 특히 효과적이다. 다른 방법으로는서는 적정법, 질량 분석법, 기체 크로마토그래피법, 그리고 자기 공명법 등을 들 수 있다. 때로는 반응 혼합물의 광활성도를 측정하는 편광 계량법이 이용되기도 하는데 이 실험에서는 이방법을 이용하였다. (1)
설탕의 반전반응은 설탕이 D-글루코오스와 D-프락토오스로 바뀌는 화학반응이다. 반응물과 생성물의 광학 활성도의 차이 때문에 반응이 진행함에 따라 광학 활성도의 반전이 생긴다. 반전과정의 방정식은
C12H22O11(슈크로오스) + H2O = C6H12O6(D-글루코오스) + C6H12O6(D-프락토오스)
이 반응은 다른 여러 가수분해 반응처럼 수소이온이 촉매작용을 한다. 더욱더 효과적인 촉매는 효소 인버타제가 이용되기도 한다.(2)
이 실험에서 반응물과 생성물의 광학 활성도가 다르기 때문에 반응의 진행 과정을 시간에 대한 회전각도를 측정함으로써 알 수 있었다. 슈크로오스와 D-글루코오스는 우회전성이고 D-프락토오스는 좌회전성이다. 반응이 진행함에 따라 용액은 점차로 우회전성이 줄어들어 나중에는 회전 각도가 영인 점을 지나서 좌회전성이 되는데 D-프락토오스가 D-글루코오스의 우회전성인 정도보다 더 많이 좌회전성이기 때문이다.
효소없는 산촉매반응에 대하여 lne(αt - α∞) 대 t를 그래프로 그려서 실험치들을 통과하는 가정 좋은 직선을 그려서 기울기를 측정하면 그 값이 반응속도 상수 k 이다. 여기서
αt는 시간 t에서의 회전각도이고, α∞는 반응이 끝난 후의 회전각도이다.
효소 촉매가 없는 경우에는 반응속도는 단지 슈크로오스 농도에만 의존하는 일차반응의 성질을 가진다.
1차 반응에서
반응물 A가 소모되는 1차 속 법칙은 다음과 같이 표시된다.
(a)
이 법칙은 다음과 같은 해를 갖는다.
(b)
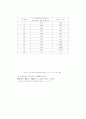
(a)tlrdp dmlgkaus ln[A]/[A]0를 t에 대해서 도시할 경우 1차 반응은 기줄기가 -k인 직선을 나타내야 한다. 이 방법으로 구한 몇가지 1차 반응의 경우에는 반응물의 속도상수 값을 아래(표27-6)에 나타내었다. (3)
Table 27-6 1차 반응에 관한 반응 속도론적 데이터
phase
θ/℃
k/s-1
C2H6→2CH3
g
700
5.36×10-4
Cyclopropane→propene
g
500
6.71×10-4
CH3N2CH3→C2H6+N2
g
327
3.4×10-4
Sucrose→glycose+fructose
aq(H+)
25
6.0×10-5
6. Conclusion
상온에서 슈크로오스의 반응속도 상수는 -16.0 라는 결과를 얻을 수 있다.
40℃에서 슈크로오스의 반응속도 상수는 -17.4 라는 결과를 얻을 수 있다.
7. Reference
(1)(3) 물리화학, P. W. Atkins 저, 안운선 역, 청문각, 1996년, P 1028-1038, c27
(2) 생화학, Lubert Stryer 저, 박인원 외 8인 역, 서울외국서적, 1999년,202-206
설탕의 반전반응은 설탕이 D-글루코오스와 D-프락토오스로 바뀌는 화학반응이다. 반응물과 생성물의 광학 활성도의 차이 때문에 반응이 진행함에 따라 광학 활성도의 반전이 생긴다. 반전과정의 방정식은
C12H22O11(슈크로오스) + H2O = C6H12O6(D-글루코오스) + C6H12O6(D-프락토오스)
이 반응은 다른 여러 가수분해 반응처럼 수소이온이 촉매작용을 한다. 더욱더 효과적인 촉매는 효소 인버타제가 이용되기도 한다.(2)
이 실험에서 반응물과 생성물의 광학 활성도가 다르기 때문에 반응의 진행 과정을 시간에 대한 회전각도를 측정함으로써 알 수 있었다. 슈크로오스와 D-글루코오스는 우회전성이고 D-프락토오스는 좌회전성이다. 반응이 진행함에 따라 용액은 점차로 우회전성이 줄어들어 나중에는 회전 각도가 영인 점을 지나서 좌회전성이 되는데 D-프락토오스가 D-글루코오스의 우회전성인 정도보다 더 많이 좌회전성이기 때문이다.
효소없는 산촉매반응에 대하여 lne(αt - α∞) 대 t를 그래프로 그려서 실험치들을 통과하는 가정 좋은 직선을 그려서 기울기를 측정하면 그 값이 반응속도 상수 k 이다. 여기서
αt는 시간 t에서의 회전각도이고, α∞는 반응이 끝난 후의 회전각도이다.
효소 촉매가 없는 경우에는 반응속도는 단지 슈크로오스 농도에만 의존하는 일차반응의 성질을 가진다.
1차 반응에서
반응물 A가 소모되는 1차 속 법칙은 다음과 같이 표시된다.
(a)
이 법칙은 다음과 같은 해를 갖는다.
(b)
(a)tlrdp dmlgkaus ln[A]/[A]0를 t에 대해서 도시할 경우 1차 반응은 기줄기가 -k인 직선을 나타내야 한다. 이 방법으로 구한 몇가지 1차 반응의 경우에는 반응물의 속도상수 값을 아래(표27-6)에 나타내었다. (3)
Table 27-6 1차 반응에 관한 반응 속도론적 데이터
phase
θ/℃
k/s-1
C2H6→2CH3
g
700
5.36×10-4
Cyclopropane→propene
g
500
6.71×10-4
CH3N2CH3→C2H6+N2
g
327
3.4×10-4
Sucrose→glycose+fructose
aq(H+)
25
6.0×10-5
6. Conclusion
상온에서 슈크로오스의 반응속도 상수는 -16.0 라는 결과를 얻을 수 있다.
40℃에서 슈크로오스의 반응속도 상수는 -17.4 라는 결과를 얻을 수 있다.
7. Reference
(1)(3) 물리화학, P. W. Atkins 저, 안운선 역, 청문각, 1996년, P 1028-1038, c27
(2) 생화학, Lubert Stryer 저, 박인원 외 8인 역, 서울외국서적, 1999년,202-206
추천자료
 [예비+결과보고서]실험7. 옥살레이트-철 착화합물의 합성과 광화학 반응
[예비+결과보고서]실험7. 옥살레이트-철 착화합물의 합성과 광화학 반응 옥살레이트-철 화합물의 합성과 광화학 반응
옥살레이트-철 화합물의 합성과 광화학 반응 분석화학 - 편광계에 의한 설탕 농도 측정
분석화학 - 편광계에 의한 설탕 농도 측정 [일반화학실험] 마그네슘의 연소 - 이번 실험은 일정 성분비의 법칙에 관한 것이다. 마그네슘...
[일반화학실험] 마그네슘의 연소 - 이번 실험은 일정 성분비의 법칙에 관한 것이다. 마그네슘... [유기 화학] Aldol condensation(알돌축합) : 디벤잘아세톤을 벤즈알데히드와 아세톤을 이용...
[유기 화학] Aldol condensation(알돌축합) : 디벤잘아세톤을 벤즈알데히드와 아세톤을 이용... [일반화학실험] 평형상수의 결정 : 색깔을 비교하는 방법으로 착이온의 농도를 알아내어 착이...
[일반화학실험] 평형상수의 결정 : 색깔을 비교하는 방법으로 착이온의 농도를 알아내어 착이... [일반화학실험] 엔탈피 측정 : 산과 염기의 중화반응을 이용해서 엔탈피가 상태함수임을 확인...
[일반화학실험] 엔탈피 측정 : 산과 염기의 중화반응을 이용해서 엔탈피가 상태함수임을 확인... [일반화학실험] 헤스의 법칙(Hess`s law) : 수산화나트륨과 염산의 반응을 통해 헤스의 법칙...
[일반화학실험] 헤스의 법칙(Hess`s law) : 수산화나트륨과 염산의 반응을 통해 헤스의 법칙... [일반화학실험] 산화-환원 적정 과망간산법 : 과망간산 칼륨과 과산화 수소의 산화-환원 반응...
[일반화학실험] 산화-환원 적정 과망간산법 : 과망간산 칼륨과 과산화 수소의 산화-환원 반응... [일반화학실험] 산화-환원 적정 (과망간산법) : 과망간산 칼륨과 과산화수소의 산화-환원반응...
[일반화학실험] 산화-환원 적정 (과망간산법) : 과망간산 칼륨과 과산화수소의 산화-환원반응... [일반화학실험] 엔탈피 측정 : 엔탈피가 상태함수임을 알고 산과 염기의 중화반응을 이용하여...
[일반화학실험] 엔탈피 측정 : 엔탈피가 상태함수임을 알고 산과 염기의 중화반응을 이용하여... [일반화학실험] (결과) 엔탈피 측정 : 산과 염기의 중화반응을 이용하여 엔탈피가 상태함수임...
[일반화학실험] (결과) 엔탈피 측정 : 산과 염기의 중화반응을 이용하여 엔탈피가 상태함수임... [일반화학실험] 질량 측정과 액체 옮기기 예비보고서 : 색깔을 비교하는 방법으로 착이온의 ...
[일반화학실험] 질량 측정과 액체 옮기기 예비보고서 : 색깔을 비교하는 방법으로 착이온의 ...