목차
TABLE OF CONTENTS
TABLE OF CONTENTS
LIST OF FIGURES & TABLES
ABSTRACT
1. INTRODUCTION
1.1 기-액 평형
1.2 증류
1.3 단증류
1.3.1 단증류의 원리
1.4 메탄올의 밀도와 조성
1.5 실험 목적
EXPERIMENTAL
2.1 실험 기구
2.2 실험 방법
2.3 실험 시 주의사항
3. RESULTS & DISCUSSION
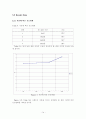
3.1 Raw Data
3.2 Data Calculation
3.3 Result Data
4. Conclusion
REFERENCES
TABLE OF CONTENTS
LIST OF FIGURES & TABLES
ABSTRACT
1. INTRODUCTION
1.1 기-액 평형
1.2 증류
1.3 단증류
1.3.1 단증류의 원리
1.4 메탄올의 밀도와 조성
1.5 실험 목적
EXPERIMENTAL
2.1 실험 기구
2.2 실험 방법
2.3 실험 시 주의사항
3. RESULTS & DISCUSSION
3.1 Raw Data
3.2 Data Calculation
3.3 Result Data
4. Conclusion
REFERENCES
본문내용
양을 채운다는 가정 하에 생각해보면 시간이 흐를수록 온도가 올라가므로 증발이 많이 되므로 그 만큼 냉각시킬 수 있는 양이 많아지기 때문에 시간이 적게 걸릴 것 같으나 온도와 냉각온도의 차이가 많이 나기 때문에 온도를 낮추는데도 시간이 걸리기 때문에 시간이 조금 더 걸릴 것으로 생각된다.
3.3.3 물질 수지
Table 7. 물질 수지
측정값
측정 방법
혼합용액
잔류용액
유출액
손실량
밀도
부피와 무게측정
0.9035
0.9427
0.8798
-
혼합용액의 전량
무게 측정
722.8g
213.04
351.91g
157.85g
조성
표에 의해 구함
(Table 1. 참조)
53%
18%
68%
-
메탄올의 양
혼합용액의 전량× 조성
383.084g
38.3472g
239.2988g
-
Table 7.은 혼합용액과 잔류용액 유출액의 물질 수지를 나타낸 표로 잔류용액의 경우 혼합용액을 채취한 양을 더해서 밀도와 전량을 구하였고 유출액의 경우 마찬가지로 응축액의 채취한 양을 더해서 구하였다. 조성의 경우 Table 1.을 참고하였으나 정확한 조성을 구하지 못하고 대략적으로 비슷한 값으로 하였다. 메탄올의 양은 혼합용액의 전량에 조성을 곱하여 구하였다.
Table 7.의 자료를 바탕으로 레이나이식을 이용하여 2성분 계에서의 조성 값을 계산해 내었다.
1) 원료의 양과 조성 및 잔류액의 조성을 아는 경우
L1 = 0.7228, x1=53, x2= 18
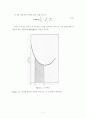
Figure 3.를 통하여 I1= 0.85 L2=1.7 I2= 0.11
식 (3-6-1)로부터
2.303 log L2 = 2.303 log 0.7228 - 0.85 + 0.11
L2 = 0.3449kg
유출액의 평균 조성은 식(3-8) 으로부터 구할 수 있다.
2) 원료의 양과 조성 및 잔류액의 양을 아는 경우
L1 = 0.7228, L2 = 0.213, x1 = 53
Figure 3.로부터 I1 = 0.85
식(3-6-2)로부터
다시 Figure 2.를 이용하여 잔류액의 조성 이론값을 구한다.
x2= 9 wt%
또 유츌액의 평균조성은 식(3-8) 으로부터 구한다.
첫 번째 방법과 두 번째 방법으로 계산한 값은 각각 y의 분율이 84.94wt%와 71.38wt %가 나왔다. 이 값을 이론값과 비교해보자. 우리조의 실험온도는 75℃에서 93℃사이이다. 이온도에서 x의 분율은 0.04 ~ 0.4 사이이고 y의 분율은 0.23~0.729 사이이다. 실제 우리가 실험한 분율은 x의 경우 0.18과 0.09이고, y의 경우 0.8494와 0.7138이었다.
4. Conclusion
이번실험은 기-액 평형 실험으로서 단증류라는 증류법을 이용하여서 기-액 평형을 실제로 실험을 통해서 알아보는데 있었다.
이번 실험에서 가장 큰 실수를 하였다. 이런 식으로 총 4번을 전원을 키고 냉각수를 틀어야 하나 우리는 냉각수를 잊어버리고 안틀고 계속 측정했기 때문에 다른 조에 비해서 온도가 높게 올라갔다. 마지막 단계에서야 냉각수를 틀어서 100℃에서 93℃로 낮아졌다. 이 과정을 제외하고 다른 과정을 보면 실험방법은 어렵지 않았다. 1A로 전류를 공급해서 증류시켰다. 시간이 흐르면 환류용기에 응축된 용액이 차기 시작해서 코크를 차례대로 열고 닫고 하여 각 단계마다 온도를 재고 용액을 추출하였고 동시에 배출코크를 열어 증류용기에서도 용액을 취하였다. 또한 비커의 빈 무게와 총 무게를 재어 용액의 무게를 재어서 부피를 이용하여 비중을 재었다. 혼합용액과 잔류용액 유출액의 용액의 경우 부피와 무게를 측정하였고 이 때 잔류용액은 증류용기에서 채취한 양도 더했으며 유출액의 경우에서 환류용기에서 채취한 용액을 구하였다.
이를 토대로 구한 값을 레이라이식과 Figure 3.을 통하여 메탄올-물계의 액상과 기상의 분율을 계산하였다. 실험 결과 값을 살펴보자. 두 가지 방법으로 나누어 계산하였는데 첫 번째는 원료의 양과 조성 및 잔류액의 조성을 통하여 구한 값이 x=0.18, y=0.8494이다. 두 번째는 원료의 양과 조성 및 잔류액의 양을 통하여 x= 0.09, y=0.7138이다. 이론값을 알아보면 우리조의 실험온도는 75℃에서 93℃사이이므로 x의 분율은 0.04 ~ 0.4 사이이고 y의 분율은 0.23~0.729 사이이다. 첫 번째 값 y는 범위 안에 들지 못하나 나머지 값은 범위 안에 든다. 그러나 이번 실험의 경우 냉각수의 실수 때문에 실험값이 옳다고 할 수 없다. 첫 번째와 두 번째의 값이 차이가 나는 이유도 냉각수 때문이다. 잔류용액이 적기 때문에 값이 달라진 것이다. 냉각이 제대로 되지 않았기 때문에 증기가 응축되지 못하고 계속해서 증발이 되었기 때문에 잔류용액의 양이 적었다. 냉각이 되지 못하므로 온도 역시 원래 온도보다 많이 올라갔기 때문에 이론값의 범위가 넓어지고 오차가 발생하였다. 다른 오차원인도 살펴보면 정확한 양의 채취가 이루어지지 않았고 용기에서 용액을 빼내 잔류액과 유출액의 총량을 구할 때 용액이 용기 안에 남아있기 때문에 여기서도 오차가 발생하였다.
냉각수의 실수로 인해 우리 실험은 이번에 단증류 실험이 아닌 증류실험이 되었다. 단증류와 증류의 차이점은 단증류는 원하는 조성의 물질들로 분리해내는 것이고 증류는 용질이 녹아 있는 용액을 증발시키고 냉각하여 순수한 용액을 얻는 것이다. 냉각이 되지 못했기 때문에 온도가 급상승하였고 이에 따라 물까지 증발하였기 때문에 단증류실험을 하지 못하였다.
마지막으로 실험을 제대로 하지 못하였기 때문에 다음 실험에는 확실하게 실험방법을 숙지하고 실험할 때도 읽어보면 실험방법을 확실하게 맞도록 해야겠다.
5. REFERENCES
[1] 박창호 외 6명, 단위조작 입문, 지인당, p.175~86
[2] warren L.McCabe·Julian C. Smith·Peter Harriott, 단위조작, 7th edition, 서울, 한국맥그로힐(주), , p619~637, 2006
[3] 화학공학실험1 (전북대학교 화학공학부) p.35~43
[4] Perry, Robert H., Green, Don W, Perry's Chemical Engineer's Handbook , McGraw-Hill, 2007
3.3.3 물질 수지
Table 7. 물질 수지
측정값
측정 방법
혼합용액
잔류용액
유출액
손실량
밀도
부피와 무게측정
0.9035
0.9427
0.8798
-
혼합용액의 전량
무게 측정
722.8g
213.04
351.91g
157.85g
조성
표에 의해 구함
(Table 1. 참조)
53%
18%
68%
-
메탄올의 양
혼합용액의 전량× 조성
383.084g
38.3472g
239.2988g
-
Table 7.은 혼합용액과 잔류용액 유출액의 물질 수지를 나타낸 표로 잔류용액의 경우 혼합용액을 채취한 양을 더해서 밀도와 전량을 구하였고 유출액의 경우 마찬가지로 응축액의 채취한 양을 더해서 구하였다. 조성의 경우 Table 1.을 참고하였으나 정확한 조성을 구하지 못하고 대략적으로 비슷한 값으로 하였다. 메탄올의 양은 혼합용액의 전량에 조성을 곱하여 구하였다.
Table 7.의 자료를 바탕으로 레이나이식을 이용하여 2성분 계에서의 조성 값을 계산해 내었다.
1) 원료의 양과 조성 및 잔류액의 조성을 아는 경우
L1 = 0.7228, x1=53, x2= 18
Figure 3.를 통하여 I1= 0.85 L2=1.7 I2= 0.11
식 (3-6-1)로부터
2.303 log L2 = 2.303 log 0.7228 - 0.85 + 0.11
L2 = 0.3449kg
유출액의 평균 조성은 식(3-8) 으로부터 구할 수 있다.
2) 원료의 양과 조성 및 잔류액의 양을 아는 경우
L1 = 0.7228, L2 = 0.213, x1 = 53
Figure 3.로부터 I1 = 0.85
식(3-6-2)로부터
다시 Figure 2.를 이용하여 잔류액의 조성 이론값을 구한다.
x2= 9 wt%
또 유츌액의 평균조성은 식(3-8) 으로부터 구한다.
첫 번째 방법과 두 번째 방법으로 계산한 값은 각각 y의 분율이 84.94wt%와 71.38wt %가 나왔다. 이 값을 이론값과 비교해보자. 우리조의 실험온도는 75℃에서 93℃사이이다. 이온도에서 x의 분율은 0.04 ~ 0.4 사이이고 y의 분율은 0.23~0.729 사이이다. 실제 우리가 실험한 분율은 x의 경우 0.18과 0.09이고, y의 경우 0.8494와 0.7138이었다.
4. Conclusion
이번실험은 기-액 평형 실험으로서 단증류라는 증류법을 이용하여서 기-액 평형을 실제로 실험을 통해서 알아보는데 있었다.
이번 실험에서 가장 큰 실수를 하였다. 이런 식으로 총 4번을 전원을 키고 냉각수를 틀어야 하나 우리는 냉각수를 잊어버리고 안틀고 계속 측정했기 때문에 다른 조에 비해서 온도가 높게 올라갔다. 마지막 단계에서야 냉각수를 틀어서 100℃에서 93℃로 낮아졌다. 이 과정을 제외하고 다른 과정을 보면 실험방법은 어렵지 않았다. 1A로 전류를 공급해서 증류시켰다. 시간이 흐르면 환류용기에 응축된 용액이 차기 시작해서 코크를 차례대로 열고 닫고 하여 각 단계마다 온도를 재고 용액을 추출하였고 동시에 배출코크를 열어 증류용기에서도 용액을 취하였다. 또한 비커의 빈 무게와 총 무게를 재어 용액의 무게를 재어서 부피를 이용하여 비중을 재었다. 혼합용액과 잔류용액 유출액의 용액의 경우 부피와 무게를 측정하였고 이 때 잔류용액은 증류용기에서 채취한 양도 더했으며 유출액의 경우에서 환류용기에서 채취한 용액을 구하였다.
이를 토대로 구한 값을 레이라이식과 Figure 3.을 통하여 메탄올-물계의 액상과 기상의 분율을 계산하였다. 실험 결과 값을 살펴보자. 두 가지 방법으로 나누어 계산하였는데 첫 번째는 원료의 양과 조성 및 잔류액의 조성을 통하여 구한 값이 x=0.18, y=0.8494이다. 두 번째는 원료의 양과 조성 및 잔류액의 양을 통하여 x= 0.09, y=0.7138이다. 이론값을 알아보면 우리조의 실험온도는 75℃에서 93℃사이이므로 x의 분율은 0.04 ~ 0.4 사이이고 y의 분율은 0.23~0.729 사이이다. 첫 번째 값 y는 범위 안에 들지 못하나 나머지 값은 범위 안에 든다. 그러나 이번 실험의 경우 냉각수의 실수 때문에 실험값이 옳다고 할 수 없다. 첫 번째와 두 번째의 값이 차이가 나는 이유도 냉각수 때문이다. 잔류용액이 적기 때문에 값이 달라진 것이다. 냉각이 제대로 되지 않았기 때문에 증기가 응축되지 못하고 계속해서 증발이 되었기 때문에 잔류용액의 양이 적었다. 냉각이 되지 못하므로 온도 역시 원래 온도보다 많이 올라갔기 때문에 이론값의 범위가 넓어지고 오차가 발생하였다. 다른 오차원인도 살펴보면 정확한 양의 채취가 이루어지지 않았고 용기에서 용액을 빼내 잔류액과 유출액의 총량을 구할 때 용액이 용기 안에 남아있기 때문에 여기서도 오차가 발생하였다.
냉각수의 실수로 인해 우리 실험은 이번에 단증류 실험이 아닌 증류실험이 되었다. 단증류와 증류의 차이점은 단증류는 원하는 조성의 물질들로 분리해내는 것이고 증류는 용질이 녹아 있는 용액을 증발시키고 냉각하여 순수한 용액을 얻는 것이다. 냉각이 되지 못했기 때문에 온도가 급상승하였고 이에 따라 물까지 증발하였기 때문에 단증류실험을 하지 못하였다.
마지막으로 실험을 제대로 하지 못하였기 때문에 다음 실험에는 확실하게 실험방법을 숙지하고 실험할 때도 읽어보면 실험방법을 확실하게 맞도록 해야겠다.
5. REFERENCES
[1] 박창호 외 6명, 단위조작 입문, 지인당, p.175~86
[2] warren L.McCabe·Julian C. Smith·Peter Harriott, 단위조작, 7th edition, 서울, 한국맥그로힐(주), , p619~637, 2006
[3] 화학공학실험1 (전북대학교 화학공학부) p.35~43
[4] Perry, Robert H., Green, Don W, Perry's Chemical Engineer's Handbook , McGraw-Hill, 2007



































소개글