목차
1.INTRODUCTION
1-1 목적
1-2 역사적인 배경
1-3 물리적 상수
1-4 이론적인 해석
2.EXPERIMENTAL
2-1 실험재료
2-2 실험방법
2-3 Abbe 굴절계
3.RESULTS & DISCUSSION
3-1 Raw data & results
3-2 함께끓는점과 메탄올의 질량비교
3-3 Discussion
4.APPENDIX
5.REFERENCES
1-1 목적
1-2 역사적인 배경
1-3 물리적 상수
1-4 이론적인 해석
2.EXPERIMENTAL
2-1 실험재료
2-2 실험방법
2-3 Abbe 굴절계
3.RESULTS & DISCUSSION
3-1 Raw data & results
3-2 함께끓는점과 메탄올의 질량비교
3-3 Discussion
4.APPENDIX
5.REFERENCES
본문내용
----(1)
M = 메탄올의 부피분율
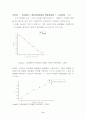
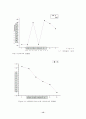
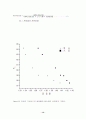
figure3.9 액상과 기상에서의 굴절률과 끓는점의 상관관계 그래프.
3-2 함께 끓는점과 메탄올의 질량 비교
Table 3-4 함께 끓는점과 메탄올의 질량(%)의 문헌값과 실험값의 비교
문 헌 값
실 험 값
오 차
함께 끓는점( )
53.8
57.5
3.7
메탄올의 질량(%)
39.6
46.5%
6.9%
메탄올의 질량(%) = "(0.704*32)" OVER "[(0.704*32) + (0.296*78)]" *100----------(2)
- 함께 끓는점 일 때 의 메탄올의 몰분율 은 0.721 일 때이므로 벤젠은 0.279이 된다. 메탄올의 질량을 전체 시료의 질량으로 나누어 준 후 100 을 곱하면 메탄올의 질량(%)를 구할 수 있다.
3-3 DISCUSSION
- 이번 실험은 최저 끓는점을 가지고 있는 2성분 액체계의 끓는점-조성곡선을 결정하고 또한 이 실험에서 2성분 액체 혼합물들의 조성을 결정하는데 사용하는 Abbe굴절계의 분석 방법을 익히는 것이었다.
실험을 하기에 앞서서 실험기구를 설치하는 과정에서 여러 가지주의를 필요로 했다. 우선은 실험에 사용되는 시약이 휘발성이 강한 것이어서 가열기를 사용하여 가열하기보다 가열 망태기를 이용하여 시료를 가열하고 실험을 하였다. 기리고 가열기를 플라스크에 가까이 놓지 말아야 하는데 그 이유는 휘발성의 기체가 새어 나오기 때문이다(가열기 사용시.) 그리고 다른 이유는 끓는점이 온도에 민감하여 갑자기 끓어올라 액체가 플라스크의 냉각기 부분까지 bumping현상을 일으키며 넘치는 경우가 있기 때문이다. 이때 온도계를 액체안에 담궈 온도를 측정하도록 한다.
위에서 말한 bumping현상을 방지하기 위해 꼭 플라스크 안에 끓임쪽을 넣어야하며, 이론상으로는 플라스크 입구 부위의 마개를 단단히 막아야 하지만 발생한 증기의 압력에 의해서 마개가 날아갈 수도 있는 위험이 있다. 실험은 메탄올 50ml, 벤젠 50ml 에 소량의 벤젠과 메탄올을 첨가하여 서로 다른 하나씩을 나누어서 실험하였다. 순수한 벤젠의 끓는점이 80 인데 실험에서는 약77 정도의 측정치를 얻을 수 있었다. 여기에 차례대로 0.3ml, 0.8ml, 1.5ml.... 의 메탄올을 넣으면서 끓는점과 조성을 측정하였다. 짧은 시간 안에 끓어올라 기체가 냉각관을 타고 냉각 관 밑에 응축되었다. 이 시료를 피펫으로 채취하고 동시에 플라스크 안에 있는 시료도 채취하여 굴절률을 측정하였다. 즉 기상과 액상에서의 조성을 비교하는 것이었었다. 벤젠에 비하면 소량인 0.3ml∼4ml에서는 끓는점과 굴절률이 순수한 벤젠 상태 일 때 와 거의 비슷하다 는걸 알 수 있었는데 메탄올의 특성이 벤젠보다 끓는점이 낮다는 것에 유의해야 한다. 소량의 메탄올이 비교적 낮은 온도인 64~70 c정도에서 증기로 변화하여 냉각된 후 응축되어 모이는데. 충분히 가열할 경우 소량의 메탄올이 거의 모두 증기로 변해서 액상에서는 거의 성분이 남아있지 않아서 순수한 벤젠과 거의 차이를 보이지 않았을 것이다.
이밖에도 다른 오차의 원인으로는 bumping현상을 보인 후 에 교재에 나온 데로 응축된 기체가 모이는 곳에 잔류하고 있는 미량의 액체를 기구를 2~3번 기울여서 충분히 결과에 영향을 주지 않을 정도로 했어야 했는데. 기구가 이미 설치가 되어있었고 플라스크가 가열되어 약간 위험이 따를 것 같아서 실험을 중단하지 못했다.
책에서 볼 수 있는 이상기체에서의 그래프의 모양은 아니었지만 우리가 보아왔던 그래프와 거의 유사한 결과를 얻었다. 하지만 실험치가 여러 개 중에 하나만 오차가 심하게 나도 그래프의 모양은 이론에서의 모양과 많이 동떨어지게 된다. 그러나 곡선들에 연결되지 않는 간격이 생겼다.
그래도 함께 끓는점이 확실하게 명시되었다는 점에서 실험이 어느 정도 우리가목표했던 거 에 근접했다 는 걸 느낄 수 있었다. 굴절률은 소수점 3자리까지 포함되는 매우 정밀성이 요구되는 측정 방법이었는데 같은 시료를 가지고도 측정하는 사람이 다르면 오차가 생기게 마련이었다. 하지만, 실험 조 모두 정확하게 읽었으므로 오차가 그리 심하지 않을 것이다.
우리가 기준으로 삼을 수 있는 기본 데이터가 주어지고 우리가 알고자 하는 미지의 혼합률을 가진 시료가있을 때 무게% 나 몰분율을 이용하면 보다 쉽게 그래프에서 근접한 값을 얻을 수 있을 것 같다.
2학기 들어서 처음 하는 실험이었는데 1학기와는 다른주제와 다른 실험 목표를 가지고 하는것이어서 긴장도 되고 1학기때와는 달리 우리조를 데리고 같이 실험 하여야 하는 것이어서 나름대로 이런저런 준비를 하였지만 미흡했던점이 너무나 많았던 것 같다. 그리고 실험재료가 몸에 해로운 거라고 들었는데 조금이나마 건강에 도움이 되도록 신경써주신 김 현종 조교님께 감사드립니다.
appendixⅠ
least square method(최소자승법) (5).
Y = A + BX (A: "intercept" B:slope)
Sx = 1 over n "xi "
slope(a) = { sxy - sx*sy} over {sxx- { sx}^{2 } }
Sy = 1 over n "yi "
"inter"cept (b) = {sxx*sy-sxy*sx } over {sxx- { sx}^{ 2} }
Sxx = 1 over n SUM from { 0 } to {n} { "X"i}^{ 2}
Sxy = 1 over n SUM from { i=1 } to {n} "x"iyi
REFERENCES
(1) 신형식, "화학공학 기초실험", 전북대학교 화학공학부,
Chapter3 , 2003.
(2) G.W Castellan, "물리화학", 3rd, 탐구당, chapter 14, 1988.
(3) 이봉호, "기액평형", '기액평형에 관한 연구', page 4∼5, 1978.
(4) http://www.naver.co.kr (검색/백과사전/이공계실험)
(5) RICHARD M. FELDER & RONALD W.ROUSSEAU /
"elementary principles of chemical process" APPENDIX Ⅰ page589~590, 1986.
-19-
M = 메탄올의 부피분율
figure3.9 액상과 기상에서의 굴절률과 끓는점의 상관관계 그래프.
3-2 함께 끓는점과 메탄올의 질량 비교
Table 3-4 함께 끓는점과 메탄올의 질량(%)의 문헌값과 실험값의 비교
문 헌 값
실 험 값
오 차
함께 끓는점( )
53.8
57.5
3.7
메탄올의 질량(%)
39.6
46.5%
6.9%
메탄올의 질량(%) = "(0.704*32)" OVER "[(0.704*32) + (0.296*78)]" *100----------(2)
- 함께 끓는점 일 때 의 메탄올의 몰분율 은 0.721 일 때이므로 벤젠은 0.279이 된다. 메탄올의 질량을 전체 시료의 질량으로 나누어 준 후 100 을 곱하면 메탄올의 질량(%)를 구할 수 있다.
3-3 DISCUSSION
- 이번 실험은 최저 끓는점을 가지고 있는 2성분 액체계의 끓는점-조성곡선을 결정하고 또한 이 실험에서 2성분 액체 혼합물들의 조성을 결정하는데 사용하는 Abbe굴절계의 분석 방법을 익히는 것이었다.
실험을 하기에 앞서서 실험기구를 설치하는 과정에서 여러 가지주의를 필요로 했다. 우선은 실험에 사용되는 시약이 휘발성이 강한 것이어서 가열기를 사용하여 가열하기보다 가열 망태기를 이용하여 시료를 가열하고 실험을 하였다. 기리고 가열기를 플라스크에 가까이 놓지 말아야 하는데 그 이유는 휘발성의 기체가 새어 나오기 때문이다(가열기 사용시.) 그리고 다른 이유는 끓는점이 온도에 민감하여 갑자기 끓어올라 액체가 플라스크의 냉각기 부분까지 bumping현상을 일으키며 넘치는 경우가 있기 때문이다. 이때 온도계를 액체안에 담궈 온도를 측정하도록 한다.
위에서 말한 bumping현상을 방지하기 위해 꼭 플라스크 안에 끓임쪽을 넣어야하며, 이론상으로는 플라스크 입구 부위의 마개를 단단히 막아야 하지만 발생한 증기의 압력에 의해서 마개가 날아갈 수도 있는 위험이 있다. 실험은 메탄올 50ml, 벤젠 50ml 에 소량의 벤젠과 메탄올을 첨가하여 서로 다른 하나씩을 나누어서 실험하였다. 순수한 벤젠의 끓는점이 80 인데 실험에서는 약77 정도의 측정치를 얻을 수 있었다. 여기에 차례대로 0.3ml, 0.8ml, 1.5ml.... 의 메탄올을 넣으면서 끓는점과 조성을 측정하였다. 짧은 시간 안에 끓어올라 기체가 냉각관을 타고 냉각 관 밑에 응축되었다. 이 시료를 피펫으로 채취하고 동시에 플라스크 안에 있는 시료도 채취하여 굴절률을 측정하였다. 즉 기상과 액상에서의 조성을 비교하는 것이었었다. 벤젠에 비하면 소량인 0.3ml∼4ml에서는 끓는점과 굴절률이 순수한 벤젠 상태 일 때 와 거의 비슷하다 는걸 알 수 있었는데 메탄올의 특성이 벤젠보다 끓는점이 낮다는 것에 유의해야 한다. 소량의 메탄올이 비교적 낮은 온도인 64~70 c정도에서 증기로 변화하여 냉각된 후 응축되어 모이는데. 충분히 가열할 경우 소량의 메탄올이 거의 모두 증기로 변해서 액상에서는 거의 성분이 남아있지 않아서 순수한 벤젠과 거의 차이를 보이지 않았을 것이다.
이밖에도 다른 오차의 원인으로는 bumping현상을 보인 후 에 교재에 나온 데로 응축된 기체가 모이는 곳에 잔류하고 있는 미량의 액체를 기구를 2~3번 기울여서 충분히 결과에 영향을 주지 않을 정도로 했어야 했는데. 기구가 이미 설치가 되어있었고 플라스크가 가열되어 약간 위험이 따를 것 같아서 실험을 중단하지 못했다.
책에서 볼 수 있는 이상기체에서의 그래프의 모양은 아니었지만 우리가 보아왔던 그래프와 거의 유사한 결과를 얻었다. 하지만 실험치가 여러 개 중에 하나만 오차가 심하게 나도 그래프의 모양은 이론에서의 모양과 많이 동떨어지게 된다. 그러나 곡선들에 연결되지 않는 간격이 생겼다.
그래도 함께 끓는점이 확실하게 명시되었다는 점에서 실험이 어느 정도 우리가목표했던 거 에 근접했다 는 걸 느낄 수 있었다. 굴절률은 소수점 3자리까지 포함되는 매우 정밀성이 요구되는 측정 방법이었는데 같은 시료를 가지고도 측정하는 사람이 다르면 오차가 생기게 마련이었다. 하지만, 실험 조 모두 정확하게 읽었으므로 오차가 그리 심하지 않을 것이다.
우리가 기준으로 삼을 수 있는 기본 데이터가 주어지고 우리가 알고자 하는 미지의 혼합률을 가진 시료가있을 때 무게% 나 몰분율을 이용하면 보다 쉽게 그래프에서 근접한 값을 얻을 수 있을 것 같다.
2학기 들어서 처음 하는 실험이었는데 1학기와는 다른주제와 다른 실험 목표를 가지고 하는것이어서 긴장도 되고 1학기때와는 달리 우리조를 데리고 같이 실험 하여야 하는 것이어서 나름대로 이런저런 준비를 하였지만 미흡했던점이 너무나 많았던 것 같다. 그리고 실험재료가 몸에 해로운 거라고 들었는데 조금이나마 건강에 도움이 되도록 신경써주신 김 현종 조교님께 감사드립니다.
appendixⅠ
least square method(최소자승법) (5).
Y = A + BX (A: "intercept" B:slope)
Sx = 1 over n "xi "
slope(a) = { sxy - sx*sy} over {sxx- { sx}^{2 } }
Sy = 1 over n "yi "
"inter"cept (b) = {sxx*sy-sxy*sx } over {sxx- { sx}^{ 2} }
Sxx = 1 over n SUM from { 0 } to {n} { "X"i}^{ 2}
Sxy = 1 over n SUM from { i=1 } to {n} "x"iyi
REFERENCES
(1) 신형식, "화학공학 기초실험", 전북대학교 화학공학부,
Chapter3 , 2003.
(2) G.W Castellan, "물리화학", 3rd, 탐구당, chapter 14, 1988.
(3) 이봉호, "기액평형", '기액평형에 관한 연구', page 4∼5, 1978.
(4) http://www.naver.co.kr (검색/백과사전/이공계실험)
(5) RICHARD M. FELDER & RONALD W.ROUSSEAU /
"elementary principles of chemical process" APPENDIX Ⅰ page589~590, 1986.
-19-
추천자료
 2성분계의 기액평형의 실험. 상평형
2성분계의 기액평형의 실험. 상평형 [과외]중학 과학 중1-06 물질의 특성 02
[과외]중학 과학 중1-06 물질의 특성 02 [과외]중학 과학 중1-06 물질의 특성 05
[과외]중학 과학 중1-06 물질의 특성 05 세라믹 흡착과 젖음에 관한 레포트 입니다.
세라믹 흡착과 젖음에 관한 레포트 입니다. 가스크로마토프래피(GC)
가스크로마토프래피(GC) 종합유체실험
종합유체실험 이산화탄소의 분자량 측정
이산화탄소의 분자량 측정 화학공학실험 다단식연속증류
화학공학실험 다단식연속증류 화공생명 기초실험 - Binary Liquid-Vapor Phase[기액평형]
화공생명 기초실험 - Binary Liquid-Vapor Phase[기액평형] 공업화학 - 크로마토그래피(Chromatography)에 관해
공업화학 - 크로마토그래피(Chromatography)에 관해 [화학공학실험] 기기분석 - GC(가스크로마토그래피)를 이용하여 휘발성 유기화합물 정량분석
[화학공학실험] 기기분석 - GC(가스크로마토그래피)를 이용하여 휘발성 유기화합물 정량분석 화학공학실험 - 기액평형 실험(기-액 평형 실험)
화학공학실험 - 기액평형 실험(기-액 평형 실험) 물의 증기압과 증발열 실험(결과 레포트)
물의 증기압과 증발열 실험(결과 레포트) 크로마토그래피 (gc)
크로마토그래피 (gc)