목차
예비:
1. 실험 제목
2. 실험조 및 실험자
3. 실험 목적
4. 실험 이론 및 배경
5. 장치 및 시약
6. 실험 방법
7. 참고 문헌
결과:
1. 실험 제목
2. 실험조 및 실험자
3. 실험 결과
4. 토의 및 고찰 (실험 기본 이론+토의/고찰)
5. 참고 문헌
1. 실험 제목
2. 실험조 및 실험자
3. 실험 목적
4. 실험 이론 및 배경
5. 장치 및 시약
6. 실험 방법
7. 참고 문헌
결과:
1. 실험 제목
2. 실험조 및 실험자
3. 실험 결과
4. 토의 및 고찰 (실험 기본 이론+토의/고찰)
5. 참고 문헌
본문내용
0^-5 M [ = (3x10^-9 x 5ml) / (50ml)]
d = 1 cm
HCl 산성: AHA = HA · C0 · d
NaOH 염기성: A = · C0 · d
HA = AHA / (C0 · d) = (0.24) / (3 x 10^-5 x 1) = 8000
= A / (C0 · d) = (0.185) / (3 x 10^-5 x 1) = 6166.67
CA- = (A - HA · C0 · d ) / d( - HA) = (0.195-0.24) / (6166.67-8000) = 2.4545 x 10^-5
CHA = C0 - CA- = 3 x 10^-5 - 2.4545 x 10^-5 = 5.455 x 10^-6
Ka = CA-CH/CHA = (2.4545 x 10^-5)(1 x 10^-9) / (5.455 x 10^-6) = 4.4995 x 10^-9
pKa = -logKa = -log(4.4995 x 10^-9) = 8.3468
2) 580nm
흡광도: 완충 용액 (A) : 0.37 / HCl (AHA) : 0.04 / NaOH (A) : 0.4
CH = 1 x 10^-9
C0 = 3 x 10^-5 M [ = (3x10^-9 x 5ml) / (50ml)]
d = 1 cm
HCl 산성: AHA = HA · C0 · d
NaOH 염기성: A = · C0 · d
HA = AHA / (C0 · d) = (0.04) / (3 x 10^-5 x 1) = 1333.3333
= A / (C0 · d) = (0.4) / (3 x 10^-5 x 1) = 13333.3333
CA- = (A - HA · C0 · d ) / d( - HA) = (0.37-0.04) / (13333.3333-1333.3333)
= 2.75 x 10^-5
CHA = C0 - CA- = 3 x 10^-5 - 2.75 x 10^-5 = 2.5 x 10^-6
Ka = CA-CH/CHA = (2.75 x 10^-5)(1 x 10^-9) / (2.5 x 10^-6) = 1.1 x 10^-8
pKa = -logKa = -log(1.1 x 10^-8) = 7.9586
3) pKa의 평균값과 오차율
-두 흡수 파장 대에서의 평균 pKa = (8.3468 + 7.9586) / 2 = 8.1527
-20℃(293K)에서의 티몰 블루의 pKa = 9.00
-오차:
4. 토의 및 고찰
이번 실험은 분석 실험에 널리 이용되는 지시약인 티몰 블루의 산해리 상수를, 각기 다른 pH 용액, 즉 pH9의 완충 용액과 HCl, NaOH 용액과의 혼합물의 UV-VIS 스펙트럼을 통해
분석하는 실험이었다.
티몰 블루는 수용액에서 약산으로 작용하여 부분적으로 해리하는데, 이 때 이온화된 성분과 이온화되지 않은 성분은 가시 광선 영역의 서로 다른 파장에서 최대 흡광도를 나타낸다.
이 지시약의 평형점을 나타내는 나 값은 가시광선 영역에서 분광기를 이용하여 측정할 수 있다. 즉, 파장 400~700nm 사이에서 온도를 일정하게 하고 묽은 HCl, 묽은 NaOH, pH가 고정된 완충 용액에 일정 농도의 티몰 블루를 용해시키고 흡광도를 측정하면, 이 결과로부터 지시약의 를 구할 수 있다.
실험 결과를 살펴보면,
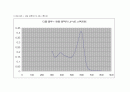
티몰 블루 + 완충 용액 피크 : 390nm , 595 nm
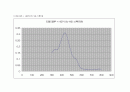
티몰 블루 + HCL : 430nm
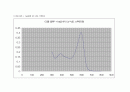
티몰 블루 + NaOH : (390nm) , 595nm
로, 390nm, 430nm, 595nm에서 최대 흡수 파장을 나타내는데, 430nm의 경우 완충 용액(A)과 NaOH(A)에서의 흡광도가 같기 때문에 사용할 수 없으므로,
(흡광도는 등흡광점이 아닌 곳(HA )에서 측정하여야 한다.)
390nm과 595nm에서의 각각의 흡광도를 이용하여 pKa를 구하고, 평균값을 내면 pKa = 8.1527 로, 20℃(293K)에서의 티몰 블루의 pKa = 9.00 와 비교하여 9.41%의 오차율을 보인다.
이렇듯 오차율이 다소 크게 나온 이유는, 우선 오차율 계산을 위해 기준으로 잡은 pKa의 이론값이 20℃에서의 값이기 때문이다. 즉, 실험 당시 실험실의 온도는 상당히 덥다고 느낄 정도였고, 이것은 약간 선선하다고 느끼는 20℃보다는 분명 높은 온도였기 때문에, 비교 대상부터가 잘못 되었다고 볼 수 있다. 다만 실험실의 온도를 정확히 측정하지 못하였고, 티몰 블루의 온도에 따른 pKa값 또한 찾을 수 없었기에 그리 추정할 뿐이다.
그리고 UV-VIS 조작 시, 셀을 증류수로 채워 영점을 보정하는 과정에서 석영 셀을 직접 손으로 만진다던가, 셀에 시료를 넣는 과정에서 발생하는 사소한 실수들 또한 오차율이 커진 원인으로 볼 수 있다.
이러한 실험기기 조작으로 인한 오차는 반복 실험으로 1~2개의 데이터를 더 얻는 방법을 통해 오차를 줄일 수 있을 것으로 생각된다.
마지막으로 실험에서 가장 중요한 역할을 한 UV-VIS 측정 원리에 대해 살펴보면, 외부에서 적당한 파장의 빛(이번 실험의 경우 가시광선 영역)을 분자에 쬐어주면 일정한 전자파 에너지를 흡수하여 들뜬 상태의 높은 에너지 상태로 변하는데 이것을 “분자전이”라하고, 이러한 상호작용 시에는 반사, 산란, 흡수, 형광/인광, 광화학적 반응이 일어나는데, 이 중 흡수 과정만 측정한 UV-VIS 스펙트럼을 이용한 것이 UV-VIS spectroscopy이다.
(흡수: 복사 에너지가 물질에 의해 흡수되어 물질과 에너지 사이에 작용이 일어나는 것.)
또한 전자 전이에 필요한 빛에너지의 크기 및 세기는 분자내의 전자구조, 즉 분자의 화학결합상태나 기하학적 구조 등에 따라 다르게 나타나므로, 분자의 전자 구조적 성질을 규명하는데 매우 유용하다.
5. 참고 문헌
물리화학실험, 대한화학회, 청문각, 2008, p69-76
http://www.chemexper.com
http://chemistory.tistory.com
http://www.kosha.net/index.jsp (MSDS)
http://www.cheric.org (화학공학연구정보센터)
○ 티몰 블루 + 완충 용액의 UV-VIS 스펙트럼
○ 티몰 블루 + HCl의 UV-VIS 스펙트럼
○ 티몰 블루 + NaOH의 UV-VIS 스펙트럼
d = 1 cm
HCl 산성: AHA = HA · C0 · d
NaOH 염기성: A = · C0 · d
HA = AHA / (C0 · d) = (0.24) / (3 x 10^-5 x 1) = 8000
= A / (C0 · d) = (0.185) / (3 x 10^-5 x 1) = 6166.67
CA- = (A - HA · C0 · d ) / d( - HA) = (0.195-0.24) / (6166.67-8000) = 2.4545 x 10^-5
CHA = C0 - CA- = 3 x 10^-5 - 2.4545 x 10^-5 = 5.455 x 10^-6
Ka = CA-CH/CHA = (2.4545 x 10^-5)(1 x 10^-9) / (5.455 x 10^-6) = 4.4995 x 10^-9
pKa = -logKa = -log(4.4995 x 10^-9) = 8.3468
2) 580nm
흡광도: 완충 용액 (A) : 0.37 / HCl (AHA) : 0.04 / NaOH (A) : 0.4
CH = 1 x 10^-9
C0 = 3 x 10^-5 M [ = (3x10^-9 x 5ml) / (50ml)]
d = 1 cm
HCl 산성: AHA = HA · C0 · d
NaOH 염기성: A = · C0 · d
HA = AHA / (C0 · d) = (0.04) / (3 x 10^-5 x 1) = 1333.3333
= A / (C0 · d) = (0.4) / (3 x 10^-5 x 1) = 13333.3333
CA- = (A - HA · C0 · d ) / d( - HA) = (0.37-0.04) / (13333.3333-1333.3333)
= 2.75 x 10^-5
CHA = C0 - CA- = 3 x 10^-5 - 2.75 x 10^-5 = 2.5 x 10^-6
Ka = CA-CH/CHA = (2.75 x 10^-5)(1 x 10^-9) / (2.5 x 10^-6) = 1.1 x 10^-8
pKa = -logKa = -log(1.1 x 10^-8) = 7.9586
3) pKa의 평균값과 오차율
-두 흡수 파장 대에서의 평균 pKa = (8.3468 + 7.9586) / 2 = 8.1527
-20℃(293K)에서의 티몰 블루의 pKa = 9.00
-오차:
4. 토의 및 고찰
이번 실험은 분석 실험에 널리 이용되는 지시약인 티몰 블루의 산해리 상수를, 각기 다른 pH 용액, 즉 pH9의 완충 용액과 HCl, NaOH 용액과의 혼합물의 UV-VIS 스펙트럼을 통해
분석하는 실험이었다.
티몰 블루는 수용액에서 약산으로 작용하여 부분적으로 해리하는데, 이 때 이온화된 성분과 이온화되지 않은 성분은 가시 광선 영역의 서로 다른 파장에서 최대 흡광도를 나타낸다.
이 지시약의 평형점을 나타내는 나 값은 가시광선 영역에서 분광기를 이용하여 측정할 수 있다. 즉, 파장 400~700nm 사이에서 온도를 일정하게 하고 묽은 HCl, 묽은 NaOH, pH가 고정된 완충 용액에 일정 농도의 티몰 블루를 용해시키고 흡광도를 측정하면, 이 결과로부터 지시약의 를 구할 수 있다.
실험 결과를 살펴보면,
티몰 블루 + 완충 용액 피크 : 390nm , 595 nm
티몰 블루 + HCL : 430nm
티몰 블루 + NaOH : (390nm) , 595nm
로, 390nm, 430nm, 595nm에서 최대 흡수 파장을 나타내는데, 430nm의 경우 완충 용액(A)과 NaOH(A)에서의 흡광도가 같기 때문에 사용할 수 없으므로,
(흡광도는 등흡광점이 아닌 곳(HA )에서 측정하여야 한다.)
390nm과 595nm에서의 각각의 흡광도를 이용하여 pKa를 구하고, 평균값을 내면 pKa = 8.1527 로, 20℃(293K)에서의 티몰 블루의 pKa = 9.00 와 비교하여 9.41%의 오차율을 보인다.
이렇듯 오차율이 다소 크게 나온 이유는, 우선 오차율 계산을 위해 기준으로 잡은 pKa의 이론값이 20℃에서의 값이기 때문이다. 즉, 실험 당시 실험실의 온도는 상당히 덥다고 느낄 정도였고, 이것은 약간 선선하다고 느끼는 20℃보다는 분명 높은 온도였기 때문에, 비교 대상부터가 잘못 되었다고 볼 수 있다. 다만 실험실의 온도를 정확히 측정하지 못하였고, 티몰 블루의 온도에 따른 pKa값 또한 찾을 수 없었기에 그리 추정할 뿐이다.
그리고 UV-VIS 조작 시, 셀을 증류수로 채워 영점을 보정하는 과정에서 석영 셀을 직접 손으로 만진다던가, 셀에 시료를 넣는 과정에서 발생하는 사소한 실수들 또한 오차율이 커진 원인으로 볼 수 있다.
이러한 실험기기 조작으로 인한 오차는 반복 실험으로 1~2개의 데이터를 더 얻는 방법을 통해 오차를 줄일 수 있을 것으로 생각된다.
마지막으로 실험에서 가장 중요한 역할을 한 UV-VIS 측정 원리에 대해 살펴보면, 외부에서 적당한 파장의 빛(이번 실험의 경우 가시광선 영역)을 분자에 쬐어주면 일정한 전자파 에너지를 흡수하여 들뜬 상태의 높은 에너지 상태로 변하는데 이것을 “분자전이”라하고, 이러한 상호작용 시에는 반사, 산란, 흡수, 형광/인광, 광화학적 반응이 일어나는데, 이 중 흡수 과정만 측정한 UV-VIS 스펙트럼을 이용한 것이 UV-VIS spectroscopy이다.
(흡수: 복사 에너지가 물질에 의해 흡수되어 물질과 에너지 사이에 작용이 일어나는 것.)
또한 전자 전이에 필요한 빛에너지의 크기 및 세기는 분자내의 전자구조, 즉 분자의 화학결합상태나 기하학적 구조 등에 따라 다르게 나타나므로, 분자의 전자 구조적 성질을 규명하는데 매우 유용하다.
5. 참고 문헌
물리화학실험, 대한화학회, 청문각, 2008, p69-76
http://www.chemexper.com
http://chemistory.tistory.com
http://www.kosha.net/index.jsp (MSDS)
http://www.cheric.org (화학공학연구정보센터)
○ 티몰 블루 + 완충 용액의 UV-VIS 스펙트럼
○ 티몰 블루 + HCl의 UV-VIS 스펙트럼
○ 티몰 블루 + NaOH의 UV-VIS 스펙트럼





































소개글