목차
< 목차 >
<목차> …… 1
[서론]
1. 기체의 성질 …… 2
[본론]
2. 보일의 법칙(Boyle's law) - 압력과 부피의 관계 …… 3
3. 샤를의 법칙(Charles' law) - 온도와 부피의 관계 …… 4
4. 게이뤼삭의 법칙(Gay-Lussac's law) - 온도와 압력의 관계 …… 7
5. 결합된 기체법칙(Combined gas law)=보일-샤를의 법칙(boyle's-Charles's law) …… 7
6. 아보가드로의 법칙(Avogadro's law) - 부피와 양의 관계 …… 8
7. 이상기체의 법칙(ideal gas law) - P, V, T, n사이의 관계 …… 9
8. 돌턴의 부분 압력 법칙(Dalton's law of partial pressure) …… 10
=혼합기체의 법칙
[결론]
9. 결론 및 고찰 …… 13
[참고 문헌 및 참고 자료] …… 14
<목차> …… 1
[서론]
1. 기체의 성질 …… 2
[본론]
2. 보일의 법칙(Boyle's law) - 압력과 부피의 관계 …… 3
3. 샤를의 법칙(Charles' law) - 온도와 부피의 관계 …… 4
4. 게이뤼삭의 법칙(Gay-Lussac's law) - 온도와 압력의 관계 …… 7
5. 결합된 기체법칙(Combined gas law)=보일-샤를의 법칙(boyle's-Charles's law) …… 7
6. 아보가드로의 법칙(Avogadro's law) - 부피와 양의 관계 …… 8
7. 이상기체의 법칙(ideal gas law) - P, V, T, n사이의 관계 …… 9
8. 돌턴의 부분 압력 법칙(Dalton's law of partial pressure) …… 10
=혼합기체의 법칙
[결론]
9. 결론 및 고찰 …… 13
[참고 문헌 및 참고 자료] …… 14
본문내용
기체라도 같은 수의 분자를 가지는데 이 기체들이 반응할 때, 반응물과 생성물 사이에는 일정한 정수비가 성립한다.
7. 이상기체의 법칙(ideal gas law) - P, V, T, n사이의 관계
기체의 상태(압력, 온도, 부피 등)들이 서로 어떤 관계인지를 나타내는 방정식이다. 그런데 일반적인 상황에서 기체의 방정식은 너무나 복잡하므로 원리를 이해하고 기본적인 관계를 알 수 있도록 이상적인 상태의 기체를 만들게 되는데, 이를 이상기체라고 한다. 이상기체는 일반기체와는 다른 특징을 가지고 있다.
이상기체의 압력(P), 부피(V), 온도(T)의 관계를 나타낸 식을 이상기체상태방정식 이라고 하는데, 다음과 같다.
PV = nRT
여기서, n은 기체의 몰수로서 기체분자가 몇 개 인지를 나타내는 값이고, R은 기체보편상수 이다. 따라서 위의 식에서 n과 R은 변하지 않는 값으로 볼 수 있고,
PV ∝ T (부피와 압력의 곱은 온도와 비례한다.)로도 표현할 수 있다.
※ 참고
n: 몰 (1몰 = 6.02 x 10^23개의 분자수) (0℃ 1기압에서 1몰은 22.4L의 부피를 가짐.)
R: 기체상수 (이상기체 방정식에서는 0.082로 고정)
T: 절대온도 (기본단위: K)
이 식을 좀 더 쉽게 설명하자면,
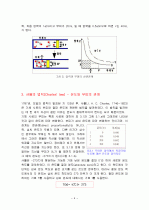
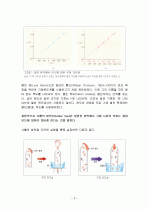
1. 온도가 일정할 때(T값이 변하지 않을 때), 압력이 증가하면 부피가 감소한다.
ex) 주사기를 누르면(압력을 증가시키면) 주사기 내의 공기 부피가 감소한다.
2. 압력이 일정할 때(P값이 변하지 않을 때) 온도가 증가하면 부피도 증가한다.
ex) 찌그러진 탁구공을 따뜻한 물속에 넣으면 부피가 증가하여 다시 펴진다.
3. 부피가 일정할 때(V값이 변하지 않을 때) 온도가 증가하면 압력도 증가한다.
ex) 꽉 닫힌 병을 뜨거운 물속에 넣으면 내부의 압력이 커져서 점점 부풀다가 결국 압력이 너무 커지면 터지게 된다.
이와 같이 온도나 부피나 압력이 서로 주는 영향에 관한 법칙이 이상기체 법칙이다.
8. 돌턴의 부분 압력 법칙(Dalton's law of partial pressure)
=혼합기체의 법칙
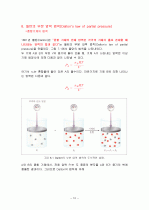
1801년 돌턴(Dalton)은 “혼합 기체의 전체 압력은 각각의 기체가 홀로 존재할 때 나타내는 압력의 합과 같다”는 돌턴의 부분 압력 법칙(Dalton's law of partial pressure)을 만들었다. 그림 7.1에서 돌턴의 법칙을 나타내었다.
두 기체 A와 B가 부피 V의 용기에 들어 있을 때, 기체 A가 나타내는 압력은 이상 기체 방정식에 의해 다음과 같이 나타낼 수 있다.
여기서 nA는 혼합물에 들어 있은 A의 몰수이다. 마찬가지로 기체 B에 의해 나타나는 압력은 다음과 같다.
A와 B의 혼합 기체에서, 전체 압력 PT는 두 종류의 분자들 A와 B가 용기의 벽에 충돌한 결과이다. 그러므로 Dalton의 법칙에 의해
여기서 n은 존재하는 기체의 총 몰수로서 n=nA+nB로 주어지며, PA와 PB는 기체 A, B의 각각의 부분 압력이다. 기체 혼합물에서 전체 압력 PT는 기체의 종류에는 무관하고, 기체의 몰수에 의해서만 결정된다.
일반적으로 혼합 기체의 전체 압력은 다음과 같다.
여기서 P1, P2, P3, …는 혼합 기체를 구성하는 기체 1,2,3,…의 부분 압력이다. 각각의 부분 압력과 전체 압력이 어떤 관계가 있는지 알아보기 위하여 기체 A와 B가 혼합 된 경우를 생각해 보자. PA를 PT로 나누면 다음과 같이 된다.
여기서 XA는 A 기체의 몰분율이다. 몰분율(mole fraction)은 전체 구성 기체의 몰수에 대한 한 성분의 몰수비를 나타내는 단위가 없는 양이다. 일반적으로 혼합 기체 중의 성분 i의 몰분율은 다음과 같이 표시된다.
여기서 ni와 nT는 각각 성분 i의 몰수와 전체 몰수이다. 이 값은 항상 1보다 작다. 또한 A의 부분 압력은 다음과 같이 쓸 수 있다.
마찬가지로
기체 혼합물의 몰분율 합은 반드시 1이 된다. 기체 혼합물의 두 구성 성분으로 구성되어 있는 경우는 다음과 같다.
두 가지 이상의 기체로 구성된 혼합물인 경우, i번째 구성 성분의 부분 압력은 전체 압력과 다음과 같은 관계가 성립한다.
압력계로는 혼합 기체의 전체 압력만을 측정할 수 있다. 부분 압력을 얻기 위해서는 정밀한 화학적 분석에 의 해 몰분율을 알아야 한다. 부분 압력을 측정하는 가장 직접적인 방법은 질량 분석기를 이용하는 방법이다. 질량분석기에 의해 얻어진 봉우리의 상대적인 크기는 존재하는 각 기체의 양에 비례하고, 이것은 몰분율을 말한다.
9. 결론 및 고찰
지금까지 일반화 되어있는 기체의 법칙에 관하여 정리해 보았다.
기체의 법칙들은 앞의 법칙들이 뒤의 법칙에 적용 될 수 있도록 순서를 정하여 정리하였고, 각 각의 법칙들은 서로 연계되어 적용됨을 확인 할 수 있다.
본문의 내용을 보면 알 수 있듯이 현재 우리가 배우고 있고 일반화 되어있는 기체의 법칙들은 18세기와 19세기에 걸쳐서 보일, 샤를, 게이뤼삭, 돌턴, 아보가드로에 의하여 가설이 세워지고 증명되어졌으며 확립되었다. 이들은 서로의 법칙을 통해 자신의 법칙을 증명하기도 하고 오류를 수정하기도 하면서 기체의 법칙을 완성한 것이다. 비록, 이후 화학자들의 꾸준한 연구로 이상기체가 아닌 특정한 환경과 다양한 변수에 의하여 오류가 생긴다는 것이 발견되어지고 있지만 이 또한 화학자들의 연구로 새로운 가설이 주장되고 증명되어지고 있다(ex - 반데르발스 상태방정식).
앞으로 기회가 된다면 이러한 법칙에 대해서도 배워 볼 기회가 있었으면 한다는 생각을 하며 일반화된 기체의 법칙에 관한 보고서를 마친다.
[ 참고문헌 ]
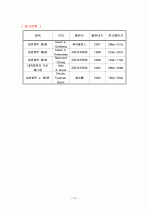
제목
저자
출판사
출판년도
참고페이지
일반화학 제5판
David E. Goldberg
싸이플러스
2007
286p~317p
일반화학 제6판
Karan C.
Timberlake
자유아카데미
1998
224p~257p
일반화학 제5판
Raymond
Chang
자유아카데미
2008
134p~170p
대학화학의 기초 제11판
Hein
& Arena
자유아카데미
2005
285p~328p
일반화학 上 제3판
Oxtoby.
Freeman.
Block
淸文閣
2000
165p~204p
7. 이상기체의 법칙(ideal gas law) - P, V, T, n사이의 관계
기체의 상태(압력, 온도, 부피 등)들이 서로 어떤 관계인지를 나타내는 방정식이다. 그런데 일반적인 상황에서 기체의 방정식은 너무나 복잡하므로 원리를 이해하고 기본적인 관계를 알 수 있도록 이상적인 상태의 기체를 만들게 되는데, 이를 이상기체라고 한다. 이상기체는 일반기체와는 다른 특징을 가지고 있다.
이상기체의 압력(P), 부피(V), 온도(T)의 관계를 나타낸 식을 이상기체상태방정식 이라고 하는데, 다음과 같다.
PV = nRT
여기서, n은 기체의 몰수로서 기체분자가 몇 개 인지를 나타내는 값이고, R은 기체보편상수 이다. 따라서 위의 식에서 n과 R은 변하지 않는 값으로 볼 수 있고,
PV ∝ T (부피와 압력의 곱은 온도와 비례한다.)로도 표현할 수 있다.
※ 참고
n: 몰 (1몰 = 6.02 x 10^23개의 분자수) (0℃ 1기압에서 1몰은 22.4L의 부피를 가짐.)
R: 기체상수 (이상기체 방정식에서는 0.082로 고정)
T: 절대온도 (기본단위: K)
이 식을 좀 더 쉽게 설명하자면,
1. 온도가 일정할 때(T값이 변하지 않을 때), 압력이 증가하면 부피가 감소한다.
ex) 주사기를 누르면(압력을 증가시키면) 주사기 내의 공기 부피가 감소한다.
2. 압력이 일정할 때(P값이 변하지 않을 때) 온도가 증가하면 부피도 증가한다.
ex) 찌그러진 탁구공을 따뜻한 물속에 넣으면 부피가 증가하여 다시 펴진다.
3. 부피가 일정할 때(V값이 변하지 않을 때) 온도가 증가하면 압력도 증가한다.
ex) 꽉 닫힌 병을 뜨거운 물속에 넣으면 내부의 압력이 커져서 점점 부풀다가 결국 압력이 너무 커지면 터지게 된다.
이와 같이 온도나 부피나 압력이 서로 주는 영향에 관한 법칙이 이상기체 법칙이다.
8. 돌턴의 부분 압력 법칙(Dalton's law of partial pressure)
=혼합기체의 법칙
1801년 돌턴(Dalton)은 “혼합 기체의 전체 압력은 각각의 기체가 홀로 존재할 때 나타내는 압력의 합과 같다”는 돌턴의 부분 압력 법칙(Dalton's law of partial pressure)을 만들었다. 그림 7.1에서 돌턴의 법칙을 나타내었다.
두 기체 A와 B가 부피 V의 용기에 들어 있을 때, 기체 A가 나타내는 압력은 이상 기체 방정식에 의해 다음과 같이 나타낼 수 있다.
여기서 nA는 혼합물에 들어 있은 A의 몰수이다. 마찬가지로 기체 B에 의해 나타나는 압력은 다음과 같다.
A와 B의 혼합 기체에서, 전체 압력 PT는 두 종류의 분자들 A와 B가 용기의 벽에 충돌한 결과이다. 그러므로 Dalton의 법칙에 의해
여기서 n은 존재하는 기체의 총 몰수로서 n=nA+nB로 주어지며, PA와 PB는 기체 A, B의 각각의 부분 압력이다. 기체 혼합물에서 전체 압력 PT는 기체의 종류에는 무관하고, 기체의 몰수에 의해서만 결정된다.
일반적으로 혼합 기체의 전체 압력은 다음과 같다.
여기서 P1, P2, P3, …는 혼합 기체를 구성하는 기체 1,2,3,…의 부분 압력이다. 각각의 부분 압력과 전체 압력이 어떤 관계가 있는지 알아보기 위하여 기체 A와 B가 혼합 된 경우를 생각해 보자. PA를 PT로 나누면 다음과 같이 된다.
여기서 XA는 A 기체의 몰분율이다. 몰분율(mole fraction)은 전체 구성 기체의 몰수에 대한 한 성분의 몰수비를 나타내는 단위가 없는 양이다. 일반적으로 혼합 기체 중의 성분 i의 몰분율은 다음과 같이 표시된다.
여기서 ni와 nT는 각각 성분 i의 몰수와 전체 몰수이다. 이 값은 항상 1보다 작다. 또한 A의 부분 압력은 다음과 같이 쓸 수 있다.
마찬가지로
기체 혼합물의 몰분율 합은 반드시 1이 된다. 기체 혼합물의 두 구성 성분으로 구성되어 있는 경우는 다음과 같다.
두 가지 이상의 기체로 구성된 혼합물인 경우, i번째 구성 성분의 부분 압력은 전체 압력과 다음과 같은 관계가 성립한다.
압력계로는 혼합 기체의 전체 압력만을 측정할 수 있다. 부분 압력을 얻기 위해서는 정밀한 화학적 분석에 의 해 몰분율을 알아야 한다. 부분 압력을 측정하는 가장 직접적인 방법은 질량 분석기를 이용하는 방법이다. 질량분석기에 의해 얻어진 봉우리의 상대적인 크기는 존재하는 각 기체의 양에 비례하고, 이것은 몰분율을 말한다.
9. 결론 및 고찰
지금까지 일반화 되어있는 기체의 법칙에 관하여 정리해 보았다.
기체의 법칙들은 앞의 법칙들이 뒤의 법칙에 적용 될 수 있도록 순서를 정하여 정리하였고, 각 각의 법칙들은 서로 연계되어 적용됨을 확인 할 수 있다.
본문의 내용을 보면 알 수 있듯이 현재 우리가 배우고 있고 일반화 되어있는 기체의 법칙들은 18세기와 19세기에 걸쳐서 보일, 샤를, 게이뤼삭, 돌턴, 아보가드로에 의하여 가설이 세워지고 증명되어졌으며 확립되었다. 이들은 서로의 법칙을 통해 자신의 법칙을 증명하기도 하고 오류를 수정하기도 하면서 기체의 법칙을 완성한 것이다. 비록, 이후 화학자들의 꾸준한 연구로 이상기체가 아닌 특정한 환경과 다양한 변수에 의하여 오류가 생긴다는 것이 발견되어지고 있지만 이 또한 화학자들의 연구로 새로운 가설이 주장되고 증명되어지고 있다(ex - 반데르발스 상태방정식).
앞으로 기회가 된다면 이러한 법칙에 대해서도 배워 볼 기회가 있었으면 한다는 생각을 하며 일반화된 기체의 법칙에 관한 보고서를 마친다.
[ 참고문헌 ]
제목
저자
출판사
출판년도
참고페이지
일반화학 제5판
David E. Goldberg
싸이플러스
2007
286p~317p
일반화학 제6판
Karan C.
Timberlake
자유아카데미
1998
224p~257p
일반화학 제5판
Raymond
Chang
자유아카데미
2008
134p~170p
대학화학의 기초 제11판
Hein
& Arena
자유아카데미
2005
285p~328p
일반화학 上 제3판
Oxtoby.
Freeman.
Block
淸文閣
2000
165p~204p
추천자료
 열역학 법칙 및 상수
열역학 법칙 및 상수 일정성분비의 법칙
일정성분비의 법칙 탄산염들의 CO2 생성반응을 통한 일정성분비의 법칙 확인
탄산염들의 CO2 생성반응을 통한 일정성분비의 법칙 확인 [과학자의 삶과 법칙] 램지 William Ramsay : 1852 - 1916
[과학자의 삶과 법칙] 램지 William Ramsay : 1852 - 1916 헤스의 법칙
헤스의 법칙 열역학 제 2법칙과 엔트로피
열역학 제 2법칙과 엔트로피 [일반화학실험] Beer의 법칙과 흡수 분광법
[일반화학실험] Beer의 법칙과 흡수 분광법 보일_샤를의 법칙 실험보고서
보일_샤를의 법칙 실험보고서 [공유결합][공유결합의 의미][공유결합의 분류][공유결합의 법칙][공유결합의 성질][공유결합...
[공유결합][공유결합의 의미][공유결합의 분류][공유결합의 법칙][공유결합의 성질][공유결합... 보일의_법칙_실험
보일의_법칙_실험 [실험보고서] 액체의 점도 측정 - Connon-Fanske viscometar의 사용법과 시료 Methanol을 이...
[실험보고서] 액체의 점도 측정 - Connon-Fanske viscometar의 사용법과 시료 Methanol을 이... 결과보고서 (액체와 기체의 압력)
결과보고서 (액체와 기체의 압력) 보일 -샤를의 법칙 실험
보일 -샤를의 법칙 실험 실험 10 액체와 기체의 압력
실험 10 액체와 기체의 압력
































소개글