목차
목적
이론 및 원리
기구 및 시약
실험 방법
실험결과
결과 해석 및 논의
참고문헌
이론 및 원리
기구 및 시약
실험 방법
실험결과
결과 해석 및 논의
참고문헌
본문내용
어 있어서 소수성이 감소하여, 1-Butanol에 비하여 상대적으로 히드록시의 친수성의 영향을 더 많이 받게 된다. 따라서 분자 전체로 친수성을 가지게되어 물에 더 잘 녹을 수 있게 된다.
4) Diethyl ether
위의 3개와 달리 작용기가 에테르인 이성질체로 에테르의 특성상 알킬기가 크며 전자가 크게 편재되지 않고, Diethyl ether의 경우 산소원자를 기준으로 알킬기가 대칭으로 이루어져 있으므로 소수성을 갖는다.
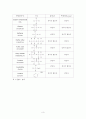
실험D에서는 카르복시기에 속하는 세 물질의 물에 대한 용해, 유기용매 중 하나인 Methylene Chloride에 대한 용해, 1.0M NaOH 수용액에 대한 용해를 관찰하여 그 성질을 알 수 있다.
cf) Methylene Chloride(Dichloromethane\'s volatility and ability to dissolve a wide range of organic compounds makes it an ideal solvent for many chemical processes-wikipedia)는 물보다 극성이 작은 유기용매
1) Acetic acid
탄소가 2개인 카르복시기으로 물과 카르복시기의 수소 결합을 할 수 있고 소수성의 알킬기 부분이 짧아 카르복시기의 친수성에 더 크게 영향을 받고 있음을 알 수 있다. 따라서 물에 녹는다.(ethanol과 같이 물과 임의의 비율로 혼합이 가능하다.) 또한 유기용매인 Methylene Chloride와도 잘 섞이며, NaOH 수용액에 넣으면
NaHCO3(s) + CH3COOH(aq) → CH3COONa(aq) + H2O(l) 와 같은 반응이 일어나 CH3COONa(aq) , 즉 염을 생성함으로 더욱 물에 잘 녹는다.
2) Stearic acid
Acetic acid 에 비해 알킬기가 매우 길어 소수성이 증가하게 되므로 물과 섞이지 않고, 극성이 약한 Methylene Chloride과는 잘 섞인다. NaOH 수용액에 넣으면 C17H35COONa(aq)와 같은 염이 형성되겠지만, 이 염 또한 알킬기가 커서 소수성이 강하므로 물에 녹지 않는다.
3) Benzoic acid
카르복시기를 가진 가장 간단한 방향족 화합물로 흰색의 고체화합물로서 벤조산은 극성을 가지나 알킬기가 크고 분자들끼리 동합체로 있으려는 경향이 커서 물에 잘 녹지 았는다.(뜨거운 물에 녹으며 3.4 g/l (25 °C)) NaOH와 반응시 C6H5COONa(aq)-염이 형성되어 물에 녹게 된다.
이 실험에서 1.0 M NaOH를 넣어 용해도를 증가 시키는 방법을 Salting In(용매에 염을 넣어 용해도를 높이는 방법)이라고 한다.
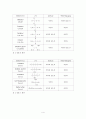
실험E는 같은 에테르기(-O-)를 가진 두 물질의 물에 대한 용해성과 NaCl을 첨가하였을 때의 변화를 관찰하여 구조에 따른 용해성과 Salting Out 과 관련지어 용질의 경쟁을 알 수 있다.
Salting Out(http://en.wikipedia.org/wiki/Salt_out
에서 발췌 및 정리)
높은 염 농도에서 단백질의 물에 대한 용해도가 떨어지는 원리를 이용하여 단백질을 분리 하는 방법으로 석출에 필요한 염 농도는 단백질 마다 다름을 이용한다. 원리에 대해 자세히 설명하면, 단백질은 친수성 아미노산과 소수성 아미노산으로 이루어져있으며 단백질이 물에 들어가면 친수성 아미노산은 용매 분자들과 상호작용 하여 단백질이 물과 수소결합 할 수 있도록 돕고, 소수성 아미노산은 소수성 부분을 만들며 물의 용해를 방해한다. 이러한 작용을 통해 단백질은 물에 용해되는데 염의 농도가 높아지면 물의 분자들이 염의 표면을 둘러싸는 작용(수화)를 하면서 친수성 아미노산과의 상호작용이 감소하게 된다. 이에 따라 단백질-단백질간의 상호작용이 용매(물)과 단백질과의 상호작용보다 강해지면서 석출(염을 가하여 석출 한다는 뜻에서 염석) 된다. 단백질은 각각 다른 아미노산으로 이루어져 있고 다른 아미노산은 각각 다른 염석에 필요한 염농도를 가지므로 이를 이용하면 원하는 단백질을 염석할 수 있다. 어떤 이온은 단백질을 변성시키거나, 염석의 원리와 반대로 단백질의 용해도를 증가시키므로 주의 해야한다.
1) Diethyl ether , Tetrahydrofuran 공통점과 차이점, 실험결과 분석
Didthyl ether는 물과 섞이지 않고 층이 나뉘어지나 THF는 물에 아주 잘 녹아 균일하게 섞인다. 이들 화합물의 공통점은 분자량은 거의 비슷하며 네 개의 탄소와 하나의 산소를 가지고 있고 에테르기를 공통적으로 가지고 있다. 차이점은 다이에틸 에테르는 비고리화합물이며 Tetrahydrofuran은 고리화합물이다. 용해도의 결과로 보아 Tetrahydrofuran가 Didthyl ether보다 극성임을 알 수 있다. 이러한 이유를 알아 보면 고리 골격을 이루는 화합물은 분자내 고리가 만들어지므로 탄소 원자와 원자사이의 단일결합에서 나타나는 회전운동이 자유롭지 못하게 된다. 이 회전운동이 자유롭지 못하면 분자는 일정한 구조를 유지하게 되고 산소의 비공유 전자쌍은 고리 바깥쪽으로 향하는 방향성이 커지게 되어 분자의 극성이 증가하게 된다.
2) NaCl을 넣었을 때 Tetrahydrofuran이 물에 섞이지 않게 된 이유
이는 앞에 설명한 염석(salting out)의 원리와 같은 이유로 염에 물 분자가 둘러 싸면서(수화작용) Tetrahydrofuran과 상호작용하는 물 분자 수가 감소하고 Tetrahydrofuran 끼리의 상호작용이 더 강해지면서 Tetrahydrofuran의 물에 대한 용해도가 감소한다.
오차의 원인 혹은 아쉬웠던 점으로는 용매, 용질의 비율이 정해져 있고 섞인다/섞이지 않는다. 로 단순히 이분화하여 구조에 의한 약간의 차이를 비교할 수 없었으며 시각에 의존한 거친 실험이었던 점이 아쉽다.
참고문헌
김홍범, 다시 쓴 유기화학 실험 제 3판 자유 아카데미 2006
Organic Chenmistry 7th, John McMurry, Thomson
현대 일반화학 5th, Oxtoby Gillis Nachtrib, 자유아카데미
http://en.wikipedia.org -위키피디아 웹백과사전
4) Diethyl ether
위의 3개와 달리 작용기가 에테르인 이성질체로 에테르의 특성상 알킬기가 크며 전자가 크게 편재되지 않고, Diethyl ether의 경우 산소원자를 기준으로 알킬기가 대칭으로 이루어져 있으므로 소수성을 갖는다.
실험D에서는 카르복시기에 속하는 세 물질의 물에 대한 용해, 유기용매 중 하나인 Methylene Chloride에 대한 용해, 1.0M NaOH 수용액에 대한 용해를 관찰하여 그 성질을 알 수 있다.
cf) Methylene Chloride(Dichloromethane\'s volatility and ability to dissolve a wide range of organic compounds makes it an ideal solvent for many chemical processes-wikipedia)는 물보다 극성이 작은 유기용매
1) Acetic acid
탄소가 2개인 카르복시기으로 물과 카르복시기의 수소 결합을 할 수 있고 소수성의 알킬기 부분이 짧아 카르복시기의 친수성에 더 크게 영향을 받고 있음을 알 수 있다. 따라서 물에 녹는다.(ethanol과 같이 물과 임의의 비율로 혼합이 가능하다.) 또한 유기용매인 Methylene Chloride와도 잘 섞이며, NaOH 수용액에 넣으면
NaHCO3(s) + CH3COOH(aq) → CH3COONa(aq) + H2O(l) 와 같은 반응이 일어나 CH3COONa(aq) , 즉 염을 생성함으로 더욱 물에 잘 녹는다.
2) Stearic acid
Acetic acid 에 비해 알킬기가 매우 길어 소수성이 증가하게 되므로 물과 섞이지 않고, 극성이 약한 Methylene Chloride과는 잘 섞인다. NaOH 수용액에 넣으면 C17H35COONa(aq)와 같은 염이 형성되겠지만, 이 염 또한 알킬기가 커서 소수성이 강하므로 물에 녹지 않는다.
3) Benzoic acid
카르복시기를 가진 가장 간단한 방향족 화합물로 흰색의 고체화합물로서 벤조산은 극성을 가지나 알킬기가 크고 분자들끼리 동합체로 있으려는 경향이 커서 물에 잘 녹지 았는다.(뜨거운 물에 녹으며 3.4 g/l (25 °C)) NaOH와 반응시 C6H5COONa(aq)-염이 형성되어 물에 녹게 된다.
이 실험에서 1.0 M NaOH를 넣어 용해도를 증가 시키는 방법을 Salting In(용매에 염을 넣어 용해도를 높이는 방법)이라고 한다.
실험E는 같은 에테르기(-O-)를 가진 두 물질의 물에 대한 용해성과 NaCl을 첨가하였을 때의 변화를 관찰하여 구조에 따른 용해성과 Salting Out 과 관련지어 용질의 경쟁을 알 수 있다.
Salting Out(http://en.wikipedia.org/wiki/Salt_out
에서 발췌 및 정리)
높은 염 농도에서 단백질의 물에 대한 용해도가 떨어지는 원리를 이용하여 단백질을 분리 하는 방법으로 석출에 필요한 염 농도는 단백질 마다 다름을 이용한다. 원리에 대해 자세히 설명하면, 단백질은 친수성 아미노산과 소수성 아미노산으로 이루어져있으며 단백질이 물에 들어가면 친수성 아미노산은 용매 분자들과 상호작용 하여 단백질이 물과 수소결합 할 수 있도록 돕고, 소수성 아미노산은 소수성 부분을 만들며 물의 용해를 방해한다. 이러한 작용을 통해 단백질은 물에 용해되는데 염의 농도가 높아지면 물의 분자들이 염의 표면을 둘러싸는 작용(수화)를 하면서 친수성 아미노산과의 상호작용이 감소하게 된다. 이에 따라 단백질-단백질간의 상호작용이 용매(물)과 단백질과의 상호작용보다 강해지면서 석출(염을 가하여 석출 한다는 뜻에서 염석) 된다. 단백질은 각각 다른 아미노산으로 이루어져 있고 다른 아미노산은 각각 다른 염석에 필요한 염농도를 가지므로 이를 이용하면 원하는 단백질을 염석할 수 있다. 어떤 이온은 단백질을 변성시키거나, 염석의 원리와 반대로 단백질의 용해도를 증가시키므로 주의 해야한다.
1) Diethyl ether , Tetrahydrofuran 공통점과 차이점, 실험결과 분석
Didthyl ether는 물과 섞이지 않고 층이 나뉘어지나 THF는 물에 아주 잘 녹아 균일하게 섞인다. 이들 화합물의 공통점은 분자량은 거의 비슷하며 네 개의 탄소와 하나의 산소를 가지고 있고 에테르기를 공통적으로 가지고 있다. 차이점은 다이에틸 에테르는 비고리화합물이며 Tetrahydrofuran은 고리화합물이다. 용해도의 결과로 보아 Tetrahydrofuran가 Didthyl ether보다 극성임을 알 수 있다. 이러한 이유를 알아 보면 고리 골격을 이루는 화합물은 분자내 고리가 만들어지므로 탄소 원자와 원자사이의 단일결합에서 나타나는 회전운동이 자유롭지 못하게 된다. 이 회전운동이 자유롭지 못하면 분자는 일정한 구조를 유지하게 되고 산소의 비공유 전자쌍은 고리 바깥쪽으로 향하는 방향성이 커지게 되어 분자의 극성이 증가하게 된다.
2) NaCl을 넣었을 때 Tetrahydrofuran이 물에 섞이지 않게 된 이유
이는 앞에 설명한 염석(salting out)의 원리와 같은 이유로 염에 물 분자가 둘러 싸면서(수화작용) Tetrahydrofuran과 상호작용하는 물 분자 수가 감소하고 Tetrahydrofuran 끼리의 상호작용이 더 강해지면서 Tetrahydrofuran의 물에 대한 용해도가 감소한다.
오차의 원인 혹은 아쉬웠던 점으로는 용매, 용질의 비율이 정해져 있고 섞인다/섞이지 않는다. 로 단순히 이분화하여 구조에 의한 약간의 차이를 비교할 수 없었으며 시각에 의존한 거친 실험이었던 점이 아쉽다.
참고문헌
김홍범, 다시 쓴 유기화학 실험 제 3판 자유 아카데미 2006
Organic Chenmistry 7th, John McMurry, Thomson
현대 일반화학 5th, Oxtoby Gillis Nachtrib, 자유아카데미
http://en.wikipedia.org -위키피디아 웹백과사전






























소개글