목차
1장 생명과학: 생명의 과학
2장 생명의 화학적 기초
3장 생명체의 유기분자
2장 생명의 화학적 기초
3장 생명체의 유기분자
본문내용
가장 안정적)
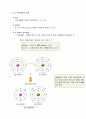
2.1.4) 원자 내 전자의 배열
전자는 끊임없이 이동한다.
원자모델은 전자껍질(에너지 수준)로 표시한다. 껍질마다 일정한수의 전자가 들어갈 수 있 다.(각 전자가 갖고 있는 에너지 수준이 다르다.)
첫 번째 껍질 ≤ 전자 2개
두 번째 이후 ≤ 전자 8개
1. 전자는 특정 E수준에 맞춰 핵 주위의 궤도를 돌고 있다.
2. 안쪽 껍질이 2개 이상이라면, 최외각 껍질에 8개의 전자가 있을 때 가장 안전하다.
3. 원심력을 가지려면 힘이 있어야 하는데, 힘의 크기를 전자껍질로 표현할 수 있다. 즉, 바깥쪽 전자껍질은 E가 상대적으로 많다.
2.1.5) 8전자 규칙
최외각 껍질
1) 원자의 껍질이 2개 이상이라면, 최외각 껍질에 8개의 전자가 있을 때 가장 안전하다.
2) 원자는 전자를 주고받거나 공유함으로써 8개를 채운다.
3) 원자의 화학적 반응성은 최외각 껍질에 있는 전자의 배열에 따라 결정된다.
4) 주기: 전자껍질의 수, 족: 최외각 껍질에 있는 전자의 수
2.1.6) 화학결합의 종류
분자
서로 결합한 원자의 집단이다(Ex. O2, H2O)
화합물
두 가지 이상의 원소의 원자로 이루어진 분자(Ex. H2O )
두 종류의 화학결합
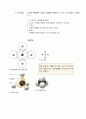
1) 이온결합 : 상반된 전하 사이의 인력에 의해 두 원자가 결합하여 생성하는 것.
원자가 껍질(최외각 껍질)에 있는 전자의 수
소듐(Na) : 전자 한 개를 내놓는다.()
염소(Cl) : 다른 원자의 전자 1개를 받는다.()
소듐원자의 전자 1개가 연소원자로 전이가 되어 최외각 전자수가 8개로 채워져 안정적이게 된다. 이때 모두 전하를 갖게 된다.
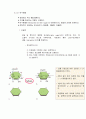
2) 공유결합 : 전자를 공유하여 최외각 껍질을 완성하는 것이다.(전자껍질이 겹쳐진 다.)
1. 두 원자가 전자를 공유한다.
2. 수소는 주변에 강력한 전자수용체가 있으면 로 된다.
3. 구조식
공유전자쌍을 직선으로 표시한다.[H-H]
4. 분자식
분자를 구성한 원자의 수만 표시한다.[H2]
메탄 분자의 구성을 표시하는 여러 가지 방식이다.(메탄가스는 공유결합을 가지게 되어 깨기가 어렵다.)
2.1.7) 이온
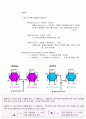
이온
전자의 전이로 인해 전하를 지닌 원자이다. 이온화합물은 흔히 염(salt, 3차원격자)형태 로 존재하게 된다.
1. 소듐(Na)은 전자 1개를 잃는다.(전자수보다 양성자수가 1개 많아서 가 된다.)
2. 염소(Cl)는 전자 1개를 얻는다.(양성자수보다 전자 수가 1개 많아서 가 된다.)
2.1.8) 화학식과 반응
반응물 : 반응에 참여하는 분자(화살표 왼쪽에 표시한다.)
생성물 : 반응에서 생성된 분자(화살표 오른쪽에 표시한다.)
반응식은 균형을 이룬다.(균형이 이루어지지 않는다면 반응이 이루어지지 않는다.)
광합성의 전체 반응식
6CO2 + 6H2O C6H8O6 + 6O2
2.2 생명체에 있어서 물의 중요성
2.2.1) 물의 중요성
생명은 물속에서 시작되었다.
생명체의 70~90%는 물이다.(물은 대사를 도와준다.)
물은 생명을 뒷받침하는 독특한 성질을 지니고 있다.
2.2.2) 물의 구조
극성 공유결합
1. 극성의 의미 : 산소와 수소가 전기적으로 달라져서 극성을 띄게 된다.
2. 산소가 수소보다 전기음성도(전자를 끌어오려는 힘(+)H+,전자를 뺏기게 되면 (-)O-)가 높기 때문에 공유전자가 균등하게 공유되지 않는다.
3. 공유전자가 산소주변에 더 오래 머문다.
4. 산소말단은 약한 음성을, 수소말단은 약한 양성 전하를 지닌다. 불균등한 전자 공 유: 쌍극자 분자
따라서 물은 수소와 산소중 산소가 전기 음성도가 크기 때문에 이 전자들이 불균등하게 공유하게 되어 쌍극자분자(음성과 양성을 가지고 있어서)를 만 들게 된다.
수소결합
+가 - 에게 끌려가는 순간 매개체가 H인 것, 물 분자의 약한 양성수소가 다른 물 분자의 약한 음성산소와 결합하는 것.
H O H (물분자 특성),동등한 상태이다.
*중요한 특성*
공유결합은 서로 공유하기 때문에 강한결합이나,
수소결합은(+)와(-)의 성질 때문에 약한 결합이다.
용매 : 물
용질 : 소금
용액 : 소금물
2.2.3) 물의 성질
물은 아주 훌륭한 용매이다.
1. 극성과 수소결합으로 인해 많은 물질을 녹인다.
-친수성: 물에 이끌리는 분자이다. 극성, 이온화 분자
-소수성: 물에 이끌리지 않는 분자이다.
2. NaCl이 물속에서 해리(분리)되는 이유
물은 높은 응집력과 부착력을 지닌다.
1. 응집
수소결합으로 인해 물 분자가 서로 들러붙는 성질을 일컫고 이 응집으로 인해 물은 통상적인 온도와 압력 하에서 액체로 존재 된다.
2. 부착
물 분자의 양극과 음극으로 인해 물이 다른 극성표면에 들러붙는 성질이다.
이러한 성질로 인해 물은 생명체에서 훌륭한 수송매체가 된다.
물은 표면장력이 크다.
1. 물 표면에 있는 물 분자는 위에 있는 공기보다 서로에게 더욱 강하게 이끌려 물 분자끼리 응집한다.
2. 주로 수소결합에 의해 이루어진다.
물은 열용량이 높다.
1. 물의 온도는 천천히 오르고 내린다.(열용량이 크다.)
수많은 수소결합에 의해 물 분자가 연결되어 있기 때문에 물은 온도가 크게 변화하지 않은 채 열을 흡수할 수 있다.
2. 기화열
물이 기화하려면 수소결합을 끊는 에너지가 많이 필요하다. 기화과정에서 열이 사라진다.(태양에너지는 물을 기화하려고 한다, 땀이 나와 기화가 되어 열을 빼앗게 되어 체온을 유지하게 된다.)
물보다 얼음의 밀도가 낮다.
1. 다른 물질과는 달리 물은 얼면서 팽창한다.
2. 얼음은 가라앉지 않고 물위에 뜬다.
3. 얼음은 단열 효과를 지닌다.
4. 이로 인해 겨울에도 물속에도 생명활동이 가능하게 된다.
수소결합을 이루는 기하학적 구조로 인해얼음의 밀도가 물보다 낮다.(물이 4도 일 때가 제일 밀도가 높다.)
2.3 산과 염기
2.3.1) 산과 염기
물이 해리되면 같은 수효의 수소이온()과 수산이온()이 방출된다.
동일한 수효로 해리 된다.
산성용액
수소이온() 농도가 더 높은 용액이다. 토마토주스, 식초 등
산(acid): 물에 녹아서 을 내놓는 물질이다.
가 100% 가깝게 해리되는 것을 강산이라고 한다.
+
여기서 는 약산이다.(수소가 일부 해리
2.1.4) 원자 내 전자의 배열
전자는 끊임없이 이동한다.
원자모델은 전자껍질(에너지 수준)로 표시한다. 껍질마다 일정한수의 전자가 들어갈 수 있 다.(각 전자가 갖고 있는 에너지 수준이 다르다.)
첫 번째 껍질 ≤ 전자 2개
두 번째 이후 ≤ 전자 8개
1. 전자는 특정 E수준에 맞춰 핵 주위의 궤도를 돌고 있다.
2. 안쪽 껍질이 2개 이상이라면, 최외각 껍질에 8개의 전자가 있을 때 가장 안전하다.
3. 원심력을 가지려면 힘이 있어야 하는데, 힘의 크기를 전자껍질로 표현할 수 있다. 즉, 바깥쪽 전자껍질은 E가 상대적으로 많다.
2.1.5) 8전자 규칙
최외각 껍질
1) 원자의 껍질이 2개 이상이라면, 최외각 껍질에 8개의 전자가 있을 때 가장 안전하다.
2) 원자는 전자를 주고받거나 공유함으로써 8개를 채운다.
3) 원자의 화학적 반응성은 최외각 껍질에 있는 전자의 배열에 따라 결정된다.
4) 주기: 전자껍질의 수, 족: 최외각 껍질에 있는 전자의 수
2.1.6) 화학결합의 종류
분자
서로 결합한 원자의 집단이다(Ex. O2, H2O)
화합물
두 가지 이상의 원소의 원자로 이루어진 분자(Ex. H2O )
두 종류의 화학결합
1) 이온결합 : 상반된 전하 사이의 인력에 의해 두 원자가 결합하여 생성하는 것.
원자가 껍질(최외각 껍질)에 있는 전자의 수
소듐(Na) : 전자 한 개를 내놓는다.()
염소(Cl) : 다른 원자의 전자 1개를 받는다.()
소듐원자의 전자 1개가 연소원자로 전이가 되어 최외각 전자수가 8개로 채워져 안정적이게 된다. 이때 모두 전하를 갖게 된다.
2) 공유결합 : 전자를 공유하여 최외각 껍질을 완성하는 것이다.(전자껍질이 겹쳐진 다.)
1. 두 원자가 전자를 공유한다.
2. 수소는 주변에 강력한 전자수용체가 있으면 로 된다.
3. 구조식
공유전자쌍을 직선으로 표시한다.[H-H]
4. 분자식
분자를 구성한 원자의 수만 표시한다.[H2]
메탄 분자의 구성을 표시하는 여러 가지 방식이다.(메탄가스는 공유결합을 가지게 되어 깨기가 어렵다.)
2.1.7) 이온
이온
전자의 전이로 인해 전하를 지닌 원자이다. 이온화합물은 흔히 염(salt, 3차원격자)형태 로 존재하게 된다.
1. 소듐(Na)은 전자 1개를 잃는다.(전자수보다 양성자수가 1개 많아서 가 된다.)
2. 염소(Cl)는 전자 1개를 얻는다.(양성자수보다 전자 수가 1개 많아서 가 된다.)
2.1.8) 화학식과 반응
반응물 : 반응에 참여하는 분자(화살표 왼쪽에 표시한다.)
생성물 : 반응에서 생성된 분자(화살표 오른쪽에 표시한다.)
반응식은 균형을 이룬다.(균형이 이루어지지 않는다면 반응이 이루어지지 않는다.)
광합성의 전체 반응식
6CO2 + 6H2O C6H8O6 + 6O2
2.2 생명체에 있어서 물의 중요성
2.2.1) 물의 중요성
생명은 물속에서 시작되었다.
생명체의 70~90%는 물이다.(물은 대사를 도와준다.)
물은 생명을 뒷받침하는 독특한 성질을 지니고 있다.
2.2.2) 물의 구조
극성 공유결합
1. 극성의 의미 : 산소와 수소가 전기적으로 달라져서 극성을 띄게 된다.
2. 산소가 수소보다 전기음성도(전자를 끌어오려는 힘(+)H+,전자를 뺏기게 되면 (-)O-)가 높기 때문에 공유전자가 균등하게 공유되지 않는다.
3. 공유전자가 산소주변에 더 오래 머문다.
4. 산소말단은 약한 음성을, 수소말단은 약한 양성 전하를 지닌다. 불균등한 전자 공 유: 쌍극자 분자
따라서 물은 수소와 산소중 산소가 전기 음성도가 크기 때문에 이 전자들이 불균등하게 공유하게 되어 쌍극자분자(음성과 양성을 가지고 있어서)를 만 들게 된다.
수소결합
+가 - 에게 끌려가는 순간 매개체가 H인 것, 물 분자의 약한 양성수소가 다른 물 분자의 약한 음성산소와 결합하는 것.
H O H (물분자 특성),동등한 상태이다.
*중요한 특성*
공유결합은 서로 공유하기 때문에 강한결합이나,
수소결합은(+)와(-)의 성질 때문에 약한 결합이다.
용매 : 물
용질 : 소금
용액 : 소금물
2.2.3) 물의 성질
물은 아주 훌륭한 용매이다.
1. 극성과 수소결합으로 인해 많은 물질을 녹인다.
-친수성: 물에 이끌리는 분자이다. 극성, 이온화 분자
-소수성: 물에 이끌리지 않는 분자이다.
2. NaCl이 물속에서 해리(분리)되는 이유
물은 높은 응집력과 부착력을 지닌다.
1. 응집
수소결합으로 인해 물 분자가 서로 들러붙는 성질을 일컫고 이 응집으로 인해 물은 통상적인 온도와 압력 하에서 액체로 존재 된다.
2. 부착
물 분자의 양극과 음극으로 인해 물이 다른 극성표면에 들러붙는 성질이다.
이러한 성질로 인해 물은 생명체에서 훌륭한 수송매체가 된다.
물은 표면장력이 크다.
1. 물 표면에 있는 물 분자는 위에 있는 공기보다 서로에게 더욱 강하게 이끌려 물 분자끼리 응집한다.
2. 주로 수소결합에 의해 이루어진다.
물은 열용량이 높다.
1. 물의 온도는 천천히 오르고 내린다.(열용량이 크다.)
수많은 수소결합에 의해 물 분자가 연결되어 있기 때문에 물은 온도가 크게 변화하지 않은 채 열을 흡수할 수 있다.
2. 기화열
물이 기화하려면 수소결합을 끊는 에너지가 많이 필요하다. 기화과정에서 열이 사라진다.(태양에너지는 물을 기화하려고 한다, 땀이 나와 기화가 되어 열을 빼앗게 되어 체온을 유지하게 된다.)
물보다 얼음의 밀도가 낮다.
1. 다른 물질과는 달리 물은 얼면서 팽창한다.
2. 얼음은 가라앉지 않고 물위에 뜬다.
3. 얼음은 단열 효과를 지닌다.
4. 이로 인해 겨울에도 물속에도 생명활동이 가능하게 된다.
수소결합을 이루는 기하학적 구조로 인해얼음의 밀도가 물보다 낮다.(물이 4도 일 때가 제일 밀도가 높다.)
2.3 산과 염기
2.3.1) 산과 염기
물이 해리되면 같은 수효의 수소이온()과 수산이온()이 방출된다.
동일한 수효로 해리 된다.
산성용액
수소이온() 농도가 더 높은 용액이다. 토마토주스, 식초 등
산(acid): 물에 녹아서 을 내놓는 물질이다.
가 100% 가깝게 해리되는 것을 강산이라고 한다.
+
여기서 는 약산이다.(수소가 일부 해리




















































소개글