목차
1.결과
2.고찰
3.참고문헌
2.고찰
3.참고문헌
본문내용
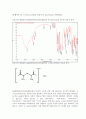
5.80cm-1, 1436.18cm-1, 1480.87cm-1, 1541.49cm-1, 1586.83cm-1이다. 그리고 phenyl 안에 있는 arene 구조를 살펴보면 탄소와 수소가 stretching vibration을 하며 결합하고 있는데 이것의 이론적 값은 3030cm-1근처 값으로 나온다. ir spectrum에서 이를 찾아보면 3048.87cm-1로 유사한 값이 나와있다. arene 구조에서 탄소와 수소가 bending vibration을 할 때, ir peak의 이론적 값은 690cm-1에서 900cm-1사이에 나타난다. 이로 추정되는 값은 ir spectrum에 총 5개가 있으며 그 값은 695.08cm-1, 717.95cm-1, 751.26cm-1, 869.05cm-1, 912.68cm-1이다. 그 다음 [Ag{CH(Ph3P)C(O)CH3}NO3의 작용기 중에 stretching vibration을 하고 있는 saturated ketone이 있다. 책에 써져있는 C=O peak의 값은 1610cm-1으로 나타나있다. 이 물질은 하나의 C=O 결합을 가지고 있으므로 peak가 1618.51cm-1으로 한 개가 나온다. 수소와 탄소(sp3) 사이에서 신축운동을 할 때의 이론적 peak값은 2850cm-1에서 3000cm-1사이에 나타난다고 한다. 이와 유사한 값으로 ir peak가 두 개 나왔는데 그 값은 2990.32cm-1와 2913.58cm-1이 나왔다.
8. Discussion
이 실험은 실험 과정 1, 2, 3을 통해 최종적으로 [Ag{CH(Ph3P)C(O)CH3}NO3을 합성하고 실험과정 1, 2, 3에서 각각 합성된 생성물을 IR spectrometer로 분석해 물질의 작용기와 구조에 대해 알아보았다. 실험과정 1번에서 Sn2반응이 일어났으며 이 과정에서 얻어진 생성물의 수득률은 54.383%가 나왔다. 이는 reflux과정에서 오차가 발생된 것으로 생각되며, Sn2반응의 과정은 다음 그림과 같다.
실험과정 2번에서는 [Ph3PCH2C(O)CH3]Cl과 NaOH를 반응시켜 Ph3P=CHC(O)CH3를 만드는 과정을 거친다. 이 과정을 통해 NaOH가 카보닐기 옆에 있는 알파 수소를 없앤다. 얻어진 생성물에서 NaOH로 수소를 제거하는 과정을 통해 수소가 제거된 탄소의 비공유전자쌍이 금속과 배위하는 데에 도움을 주게된다. 그래서 공명구조로 안정해지는 Ph3P=CHC(O)CH3를 생성한다. NaOH를 과량으로 넣어주었기 때문에 pH paper로 용액이 염기성을 띠는 것을 알 수 있었다. pH 미터를 사용하지 않고 pH paper를 써서 실험과정에서 오차가 발생하는데 영향을 준 것으로 생각된다. 실험과정 1, 2, 3번으로 구한 생성물 모두 흰색을 띠고 있었으므로 UV-Vis spectrophotometer가 아닌 IR spectrophotometer를 이용해 구조를 파악했다. Ph3P=CHC(O)CH3의 작용기 중 C=O의 IR peak보다 [Ph3PCH2C(O)CH3]Cl의 C=O의 IR peak가 더 컸다. 이는 실험과정 2에서 생성물이 수소를 잃으면서 음전하를 띄게 되었고 이로 공명구조가 발생하여 안정해졌기 때문이며 실험과정 2의 반응과정은 다음 그림과 같다.
실험과정 3번에서는 2번의 생성물과 AgNO3를 반응시켜서 [Ag{CH(Ph3P)C(O)CH3}NO3를 만들었다. 수득률이 100%가 아닌 이유는 빛을 완전히 차단하지 못하여 빛과 Ag가 일부 광반응을 했기 때문인 것 같다. 빛을 막아줘야 하는 이유는 enol form이 keto form으로 바뀌는 것을 막기 위함이다. [Ph3PCH2C(O)CH3]Cl의 C=O결합에서 나타난 IR peak가 [Ag{CH(Ph3P)C(O)CH3}NO3의 C=O결합에서 나타난 IR peak보다 더 큰 것을 이론값과 측정값으로 알 수 있다. 그 이유는 [Ph3PCH2C(O)CH3]Cl의 수소가 [Ag{CH(Ph3P)C(O)CH3}NO3의 Ag 보다 더 좋은 electron withdrawing group인데, 더 나은 electron withdrawing group을 가질수록 Ⅱ-backbonding을 잘 못하기 때문이다. 실험과정 3번의 반응과정은 다음 그림과 같다.
이번 실험을 통해 탄소와 산소사이의 이중결합의 peak에 해당하는 wave number가 물질에 따라 달랐으며 1번째 생성물이 제일 파수가 컸고 그 다음 3번째 생성물이 크고 마지막으로 두 번째 생성물의 파수가 제일 작았다. 파수는 에너지에 비례하며 두 번째 생성물이 세 번째 생성물 보다 파수가 작은 이유는 2번째 생성물은 공명구조를 갖기 때문에 에너지가 낮아져서 첫 번째 생성물보다 더 안정해지기 때문이다. 그 다음 세 번째 생성물보다 첫 번째 생성물의 파수가 큰 이유는 세 번째 생성물의 음전하를 띠고 있는 탄소의 비공유 전자쌍이 리간드의 역할을 해서 Ag에 배위해서 안정해지기 때문에 첫 번째 생성물보다 세 번째 생성물의 파수가 더 낮다. 세 실험과정에서 IR spectrum을 봤을 때, 3400cm-1근처에서 peak값이 나온다. 이는 O-H결합에 해당하는 peak로 예상되며 이는 KBr의 조해성 때문에 나타났다고 볼 수 있다. 고체 시료를 만들 때, KBr을 사용했는데 이를 사용한 이유는 KBr을 압축했을 때, 빛을 잘 투과할 만큼 투명해지기 때문이며 근적외선을 잘 흡수하지 않아 진행할 실험의 파수와 파장에 관여하지 않고 시료물질을 잘 퍼뜨려주는 성질을 가지고 있기 때문이다. 하지만 KBr은 물을 잘 흡수하는 특성인 조해성을 가지고 있으므로 공기중에 장시간 방치하거나 높은 습도를 가지는 공간에 두지 않아야 한다. 두번째 실험과정에서 NaOH를 쓰는 이유는 첫 번째 실험과정에서의 생성물이 산성을 띄기 때문에 염기를 넣어주어 중성용액을 만들어주기 위해서이다. 그리고 실험 과정에서 MgSO4를 쓰는 이유는 이는 생성물의 물기를 없애주는 역할을 하는데 이는 금속과 리간드 결합을 형성하기 전에 물기가 남아있다면 물과 금속이 리간드 결합을 해서 원하는 생성물을 만들지 못하기 때문이다.
9. 참고문헌
네이버 지식백과
이공학을 위한 무기화학 실험
8. Discussion
이 실험은 실험 과정 1, 2, 3을 통해 최종적으로 [Ag{CH(Ph3P)C(O)CH3}NO3을 합성하고 실험과정 1, 2, 3에서 각각 합성된 생성물을 IR spectrometer로 분석해 물질의 작용기와 구조에 대해 알아보았다. 실험과정 1번에서 Sn2반응이 일어났으며 이 과정에서 얻어진 생성물의 수득률은 54.383%가 나왔다. 이는 reflux과정에서 오차가 발생된 것으로 생각되며, Sn2반응의 과정은 다음 그림과 같다.
실험과정 2번에서는 [Ph3PCH2C(O)CH3]Cl과 NaOH를 반응시켜 Ph3P=CHC(O)CH3를 만드는 과정을 거친다. 이 과정을 통해 NaOH가 카보닐기 옆에 있는 알파 수소를 없앤다. 얻어진 생성물에서 NaOH로 수소를 제거하는 과정을 통해 수소가 제거된 탄소의 비공유전자쌍이 금속과 배위하는 데에 도움을 주게된다. 그래서 공명구조로 안정해지는 Ph3P=CHC(O)CH3를 생성한다. NaOH를 과량으로 넣어주었기 때문에 pH paper로 용액이 염기성을 띠는 것을 알 수 있었다. pH 미터를 사용하지 않고 pH paper를 써서 실험과정에서 오차가 발생하는데 영향을 준 것으로 생각된다. 실험과정 1, 2, 3번으로 구한 생성물 모두 흰색을 띠고 있었으므로 UV-Vis spectrophotometer가 아닌 IR spectrophotometer를 이용해 구조를 파악했다. Ph3P=CHC(O)CH3의 작용기 중 C=O의 IR peak보다 [Ph3PCH2C(O)CH3]Cl의 C=O의 IR peak가 더 컸다. 이는 실험과정 2에서 생성물이 수소를 잃으면서 음전하를 띄게 되었고 이로 공명구조가 발생하여 안정해졌기 때문이며 실험과정 2의 반응과정은 다음 그림과 같다.
실험과정 3번에서는 2번의 생성물과 AgNO3를 반응시켜서 [Ag{CH(Ph3P)C(O)CH3}NO3를 만들었다. 수득률이 100%가 아닌 이유는 빛을 완전히 차단하지 못하여 빛과 Ag가 일부 광반응을 했기 때문인 것 같다. 빛을 막아줘야 하는 이유는 enol form이 keto form으로 바뀌는 것을 막기 위함이다. [Ph3PCH2C(O)CH3]Cl의 C=O결합에서 나타난 IR peak가 [Ag{CH(Ph3P)C(O)CH3}NO3의 C=O결합에서 나타난 IR peak보다 더 큰 것을 이론값과 측정값으로 알 수 있다. 그 이유는 [Ph3PCH2C(O)CH3]Cl의 수소가 [Ag{CH(Ph3P)C(O)CH3}NO3의 Ag 보다 더 좋은 electron withdrawing group인데, 더 나은 electron withdrawing group을 가질수록 Ⅱ-backbonding을 잘 못하기 때문이다. 실험과정 3번의 반응과정은 다음 그림과 같다.
이번 실험을 통해 탄소와 산소사이의 이중결합의 peak에 해당하는 wave number가 물질에 따라 달랐으며 1번째 생성물이 제일 파수가 컸고 그 다음 3번째 생성물이 크고 마지막으로 두 번째 생성물의 파수가 제일 작았다. 파수는 에너지에 비례하며 두 번째 생성물이 세 번째 생성물 보다 파수가 작은 이유는 2번째 생성물은 공명구조를 갖기 때문에 에너지가 낮아져서 첫 번째 생성물보다 더 안정해지기 때문이다. 그 다음 세 번째 생성물보다 첫 번째 생성물의 파수가 큰 이유는 세 번째 생성물의 음전하를 띠고 있는 탄소의 비공유 전자쌍이 리간드의 역할을 해서 Ag에 배위해서 안정해지기 때문에 첫 번째 생성물보다 세 번째 생성물의 파수가 더 낮다. 세 실험과정에서 IR spectrum을 봤을 때, 3400cm-1근처에서 peak값이 나온다. 이는 O-H결합에 해당하는 peak로 예상되며 이는 KBr의 조해성 때문에 나타났다고 볼 수 있다. 고체 시료를 만들 때, KBr을 사용했는데 이를 사용한 이유는 KBr을 압축했을 때, 빛을 잘 투과할 만큼 투명해지기 때문이며 근적외선을 잘 흡수하지 않아 진행할 실험의 파수와 파장에 관여하지 않고 시료물질을 잘 퍼뜨려주는 성질을 가지고 있기 때문이다. 하지만 KBr은 물을 잘 흡수하는 특성인 조해성을 가지고 있으므로 공기중에 장시간 방치하거나 높은 습도를 가지는 공간에 두지 않아야 한다. 두번째 실험과정에서 NaOH를 쓰는 이유는 첫 번째 실험과정에서의 생성물이 산성을 띄기 때문에 염기를 넣어주어 중성용액을 만들어주기 위해서이다. 그리고 실험 과정에서 MgSO4를 쓰는 이유는 이는 생성물의 물기를 없애주는 역할을 하는데 이는 금속과 리간드 결합을 형성하기 전에 물기가 남아있다면 물과 금속이 리간드 결합을 해서 원하는 생성물을 만들지 못하기 때문이다.
9. 참고문헌
네이버 지식백과
이공학을 위한 무기화학 실험
































소개글